
【题目】NaOH、KOH等碱性溶液可以贮存在下列哪种试剂瓶中
A. 具有玻璃塞的细口瓶 B. 具有玻璃塞的广口瓶
C. 带滴管的滴瓶 D. 具有橡胶塞的细口瓶
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子
B.常温常压下,18 g H2O 中含有的原子总数为3NA
C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA
D.1 mol Cl2与1 mol Fe反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法和盐类水解无关的是
A. 热的纯碱溶液去油污能力强 B. 用饱和FeCl3溶液制备Fe (OH)3胶体
C. NaHSO4水溶液显酸性 D. 施肥时,草木灰和铵态氮肥不能混合施用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的沸点是78℃,能与水以任意比混溶,易与氯化钙结合生成配合物.乙醚的沸点为34,.6℃,难溶于水,乙醚极易燃烧.实验室制乙醚的反应原理是2CH3CH2OH ![]() CH3CH2﹣O﹣CH2CH3(乙醚)+H2O
CH3CH2﹣O﹣CH2CH3(乙醚)+H2O
实验步骤:
Ⅰ.乙醚的制备
在分液漏斗中加入2mL 95%的乙醇,在一干燥的三颈烧瓶中放入12mL 95%的乙醇,在冷水浴中的冷却下边摇动边缓慢加入12mL浓硫酸,使混合均匀,并加入2粒沸石.实验装置如图:将反应瓶放在电热套上加热,使温度迅速地上升到140℃,开始由分液漏斗慢慢滴加乙醇,控制流速并保持温度在135~140℃之间.待乙醇加完后,继续反应10min,直到温度上升到160℃止.关闭热源,停止反应.
Ⅱ.乙醚的精制
将馏出物倒入分液漏斗中,依次用8mL 15% NaOH溶液、8mL饱和食盐水洗涤,最后再用8mL饱和氯化钙溶液洗涤2次,充分静置后分液.将乙醚倒入干燥的锥形瓶中,用块状无水氯化钙干燥.待乙醚干燥后,加入到蒸馏装置中用热水浴蒸馏,收集33~38℃的馏分.
请根据上述信息,完成下列问题: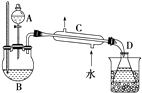
(1)乙醚的制备和精制过程中都需要使用沸石,其作用是 , 如果实验中忘记加沸石,需要怎么处理? .
(2)乙醚的制备和精制过程中都需要使用温度计,其水银球位置是否相同?(填“是”或“否”),原因是
(3)仪器C的名称为 .
(4)如果温度太高,将会发生副反应,产物是 .
(5)精制乙醚中,加入15% NaOH溶液的作用是 , 加入饱和氯化钙溶液的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关中和滴定的操作:
①用标准液润洗滴定管;
②往滴定管内注入标准溶液;
③检查滴定管是否漏水;
④滴定;
⑤滴加指示剂于待测液;
⑥洗涤.
正确的操作顺序是( )
A.⑥③①②⑤④
B.⑤①②⑥④③
C.⑤④③②①⑥
D.③①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=。
(2)若将lmol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。
①曲线I、Ⅱ对应的平衡常数大小关系为KIKⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为 , 该温度下的平衡常数为;若容器容积不变,下列措施可增加甲醇产率的是。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是 , 阳极电极反应为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是用硫酸钙生产硫酸、漂白粉等一系列物质的流程图.下列说法正确的是( ) 
A.CO、SO2、SO3均是酸性氧化物
B.图示转化反应均为氧化还原反应
C.工业上利用Cl2和澄清石灰水反应来制取漂白粉
D.用CO合成CH3OH,原子利用率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是最常见的一次电池,它的总反应如下:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH由此可知,该电池放电时的负极材料是( )
A.Zn
B.Zn(OH)2
C.MnO2
D.MnOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.5NH4NO3 ![]() 2HNO3+4N2↑+9H2O的反应中,生成28 g N2 , 转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O的反应中,生成28 g N2 , 转移的电子数目为3.75NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.标准状况下,2.24L SO3中所含原子数为0.4 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com