



 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:不详 题型:单选题
| A.中和时所需NaOH的量 | B.电离的程度 |
| C.H+的物质的量浓度 | D.CH3COOH的物质的量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中导电粒子的数目减少 |
B.溶液中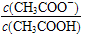 变大 变大 |
| C.醋酸的电离程度增大,c(OH-)亦增大 |
| D.再加入10 mL c(OH-)=10-3 mol·L-1的NaOH溶液,醋酸与NaOH恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入少量氯化钠溶液,平衡不移动 |
| B.加入少量NaOH固体,平衡正向移动 |
| C.通入少量氯化氢气体,平衡正向移动 |
| D.加入少量MgSO4固体,抑制NH3·H2O电离 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HA能与水以任意比互溶 |
| B.0.1 mol·L-1HA溶液的pH约为3 |
| C.HA可与NaHCO3反应放出CO2 |
| D.HA溶液的导电能力很差 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.20mL水 | B.浓盐酸 | C.冰醋酸 | D.NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.室温时,NaR溶液的pH大于7 |
| B.滴加紫色石蕊试液,溶液变红色 |
| C.HR溶液加入少量NaR固体,溶解后溶液的pH变大 |
| D.室温时,0.01mol?L—1的HR溶液pH=4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaCN | B.NaF | C.CH3COONa | D.NaNO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com