
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)写出R的原子结构示意图:________________
(2)五种元素原子半径由大到小的顺序是(写元素符号) .
(3)X与Y能形成多种化合物其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,X和Z组成的化合物的化学式为___________________
(4)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A![]() B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式 ;D的电子式 .
B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的化学式 ;D的电子式 .
①如果A、B均由三种元素组成,B为两性不溶物,则A![]() B离子反应方程式为_________
B离子反应方程式为_________
②A、B均为盐溶液,如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性.用离子方程式表示A溶液显碱性的原因 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 .
【答案】(1)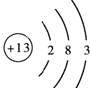 ;
;
(2)Na>Al>C>O>H
(3)C2H2; H2O和H2O2 ;
(4)CO2;![]() ;
;
①AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-;②CO32-+H2O![]() HCO3-+OH-;NaCl H2CO3NaHCO3
HCO3-+OH-;NaCl H2CO3NaHCO3
【解析】试题分析:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、R为Al;X、Y两元素最高正价与最低负价代数和均为0,原子序数均小于O元素,为ⅠA族元素、ⅣA族元素,故X为H元素、Y为C元素;Q与X同主族,结合原子序数可知,Q为Na元素。
(1)R为Al,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Na>Al>C>O>H,故答案为:Na>Al>C>O>H;
(3)H与C形成多种化合物,属于烃类物质,其中既含极性键又含非极性键,且相对分子质量最小是C2H2,H与O形成的化合物有H2O和H2O2,故答案为:C2H2;H2O和H2O2;
(4)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A![]() B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。则D是Na2O2,C是CO2,D的电子式为
B(在水溶液中进行),其中,C是溶于水显酸性的气体;D是淡黄色固体。则D是Na2O2,C是CO2,D的电子式为![]() ,故答案为:CO2;
,故答案为:CO2;![]() ;
;
①如果A、B均由三种元素组成,B为两性不溶物,则B是Al(OH)3,D是过氧化钠、C是二氧化碳,则A是偏铝酸钠,其化学式为NaAlO2,偏铝酸钠和过量二氧化碳反应生成氢氧化铝和碳酸氢根离子,离子反应方程式为:AlO2-+2H2O+CO2=Al(OH)3+HCO3-,故答案为:AlO2-+2H2O+CO2=Al(OH)3+HCO3-;
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,B和氢氧化钠反应生成A,A和二氧化碳反应生成B,所以B是碳酸氢钠、A是碳酸钠,碳酸根离子水解导致碳酸钠溶液呈碱性,水解方程式为CO32-+H2O![]() HCO3-+OH-;常温下,A、B浓度均为0.1molL-1的混合溶液中,滴加盐酸,生成NaCl,但溶液中溶解二氧化碳,溶液呈中性时,应有部分NaHCO3,则溶液中的溶质为NaHCO3、NaCl、CO2或者碳酸,故答案为:CO32-+H2O
HCO3-+OH-;常温下,A、B浓度均为0.1molL-1的混合溶液中,滴加盐酸,生成NaCl,但溶液中溶解二氧化碳,溶液呈中性时,应有部分NaHCO3,则溶液中的溶质为NaHCO3、NaCl、CO2或者碳酸,故答案为:CO32-+H2O![]() HCO3-+OH-; NaHCO3、NaCl、CO2或者碳酸
HCO3-+OH-; NaHCO3、NaCl、CO2或者碳酸


科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g) ![]() pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是

A.T1<T2 p1<p2 m+n>p放热反应
B.T1>T2 p1<p2 m+n<p吸热反应
C.T1<T2 p1>p2 m+n>p放热反应
D.T1>T2 p1<p2 m+n>p吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示,已知其燃烧时P被氧化为P4010,下列有关P4S3的说法中不正确的是

A. P4S3中磷元素为+3价
B. P4S3属于共价化合物
C. P4S3充分燃烧的化学方程式为P4S3+8O2=P4O10+3SO2
D. 1mol P4S3分子中含有9mol共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同温度条件下反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
测得CH3OH的物质的量随时间变化如图所示,回答问题:
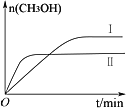
①该反应的平衡常数表达式K=_______________;
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为:KⅠ_________KⅡ(填“>”、“=”或“<”)。
③下列措施中能增大CO2转化率的是____________。(填序号)
A.升高温度 | B.充入He(g)使体系压强增大 |
C.将H2O(g)从体系中分离 | D.再充入一定量CO2 |
④下列图像正确且能表明在t时刻反应一定处于平衡状态的是__________。(填序号)
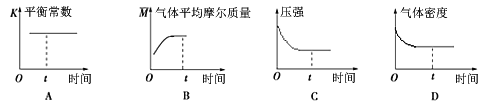
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧性硫酸盐还原菌(SRB)是导致金属微生物腐蚀最为普遍的菌种,腐蚀图解如图所示。下列说法正确的是( )
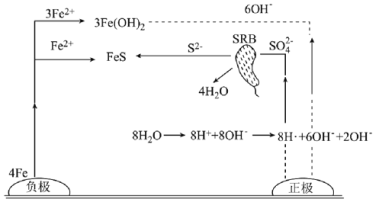
A.正极的电极反应式为8H++8e-=8H·(吸附)、SO42-+8H·(吸附)![]() S2-+4H2O
S2-+4H2O
B.正极区溶液的pH变小
C.生成1molFeS,转移6mol电子
D.若引入新细菌,一定会加速金属的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图象的解释或结论不正确的是( )

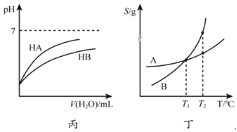
A.由甲可知:使用催化剂降低了反应的活化能
B.由乙可知:对于恒温恒容条件下的反应2NO2(g)N2O4(g),A点为平衡状态
C.由丙可知:同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
D.由丁可知:将T1℃的A、B饱和溶液升温至T2℃时,A与B溶液的质量分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )

A. 离子半径:Y<Z
B. 氢化物的沸点:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气中的![]() 可用连二亚硫酸根(
可用连二亚硫酸根(![]() )为媒介处理使其转化为
)为媒介处理使其转化为![]() ,其原理如图所示。下列说法正确的是( )
,其原理如图所示。下列说法正确的是( )

A.燃煤烟气中![]() 的处理仅利用的是电解原理
的处理仅利用的是电解原理
B.阴极区的电极反应式为![]()
C.若通电过程中吸收![]() (标准状况下),则阳极可以产生
(标准状况下),则阳极可以产生![]() 气体
气体
D.反应一段时间后,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应,硼与氯气反应生成三氯化硼(BC13),生成的三氯化硼遇水水解产生白雾(已知:BC13的熔点为 -107. 3℃,沸点为12.5 ℃)。某兴趣小组设计如图所示装置制备三氯化硼。
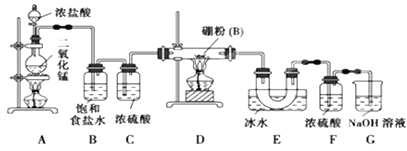
回答下列问题:
(1)写出装置A中发生反应的离子方程式________________。
(2)写出装置D中发生反应的化学方程式为_____________________。
(3)装置B、E的作用分别是________________、________________。
(4)可以用盛装____________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
(5)为了顺利完成实验,点燃酒精灯的正确操作是______(填字母),
a.先点燃A处酒精灯,后点燃D处酒精灯
b.先点燃D处酒精灯,后点燃A处酒精灯
c.同时点燃A、D两处酒精灯
其理由是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com