
【题目】白磷是一种能自燃的单质,其分子的球棍模型如图所示:![]() ,下列叙述错误的是( )
,下列叙述错误的是( )
A.每个磷原子的价层电子对数为4,磷原子均为sp3杂化
B.每个磷原子形成3个σ键,磷原子为sp2杂化
C.1mol白磷中共含6mol非极性键
D.白磷的分子构型为正四面体形
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】某同学进行实验研究时,需要配制500mL 0.1molL﹣1 Na2CO3溶液.
(1)经过计算,使用托盘天平应该称量______g Na2CO3固体;
(2)配制溶液时,除了托盘天平、药匙、量筒、烧杯、玻璃棒外,还需要的仪器有______;
(3)配制溶液时,需经过称量、溶解、转移溶液、______、定容、摇匀等操作.下列图示对应的操作规范的一个是______;
A 称量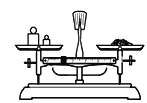
B 溶解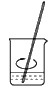
C 转移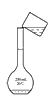
D 转移![]()
(4)误差(填偏高、偏低、无影响)
若配制溶液时,洗干净的容量瓶中残留有少量蒸馏水,则所配溶液的浓度______;若摇匀后发现液面低于刻度线,又加入少量蒸馏水与刻度线相平,则所配溶液的浓度______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
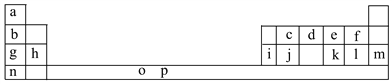
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___________________。
(2)d与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__________________________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是__________________________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
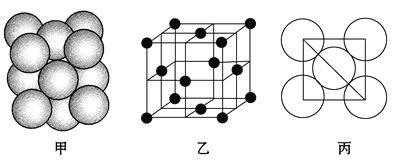
请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 合成氨反应放热,采用低温可以提高氨的生成速率
B. 常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低
C. 反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0
D. 在一容积可变的密闭容器中反应2SO2(g)+O2(g)![]() 2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,
2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
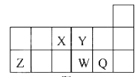
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q)
C.元素W的最高价氧化物对应的水化物的酸性比Q的强
D.离子Y2-和Z3+的核外电子数和电子层数都不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图Ⅱ表示常温下,0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲线
C. 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<c
D. 图Ⅳ表示反应4CO(g)+2NO2(g ) ![]() N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年3月南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Ni3+的价电子排布式为________;银与铜位于同一族,银元素位于元素周期表的________区。
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体结构如图1所示:
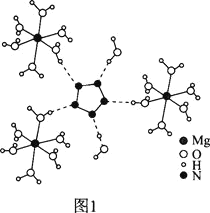
![]() 、O、Mg元素的前3级电离能如下表所示:
、O、Mg元素的前3级电离能如下表所示:
元素 | I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 |
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
X、Y、Z中为N元素的是________,判断理由是________。
②从作用力类型看,Mg2+与H2O之间是________、N5-与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是________。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如苯分子中的大
如苯分子中的大![]() 键可表示为
键可表示为![]() ,则N4-中的大
,则N4-中的大![]() 键应表示为________。
键应表示为________。
(3)AgN5的立方晶胞结构如图2所示:
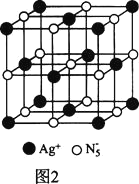
Ag+周围距离最近的Ag+有________个。若晶体中紧邻的N5-与Ag+的平均距离为anm,NA表示阿伏加德罗常数的值,则AgN5的密度可表示为________gcm-3用含a、NA的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,发生反应3A(g)+2B(g)![]() 4C(s)+2D(g),加入4molA和2molB,2min后达到平衡,测得生成1.6mol C,则下列说法正确的是:
4C(s)+2D(g),加入4molA和2molB,2min后达到平衡,测得生成1.6mol C,则下列说法正确的是:
A.该反应的化学平衡常数表达式是K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.若向平衡体系移走部分D,则此时正反应速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com