
【题目】2018年3月南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Ni3+的价电子排布式为________;银与铜位于同一族,银元素位于元素周期表的________区。
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体结构如图1所示:
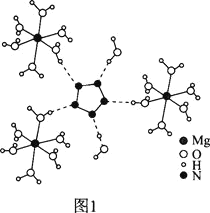
![]() 、O、Mg元素的前3级电离能如下表所示:
、O、Mg元素的前3级电离能如下表所示:
元素 | I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 |
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
X、Y、Z中为N元素的是________,判断理由是________。
②从作用力类型看,Mg2+与H2O之间是________、N5-与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是________。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如苯分子中的大
如苯分子中的大![]() 键可表示为
键可表示为![]() ,则N4-中的大
,则N4-中的大![]() 键应表示为________。
键应表示为________。
(3)AgN5的立方晶胞结构如图2所示:
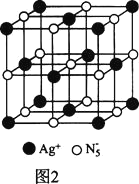
Ag+周围距离最近的Ag+有________个。若晶体中紧邻的N5-与Ag+的平均距离为anm,NA表示阿伏加德罗常数的值,则AgN5的密度可表示为________gcm-3用含a、NA的代数式表示![]() 。
。
【答案】3d7 ds Z X最外层为2个电子,X为镁,N的2p轨道处于半充满的稳定结构,故失去第一个电子较难,I1较大,则Z是氮元素 配位键 氢键 sp2 ![]()
![]()
![]()
【解析】
(1)镍的原子序数为28,则基态Ni3+的价电子排布式为3d7;银与铜位于同一族,银元素位于元素周期表的ds区;
(2)①X最外层为2个电子,X为镁,N的2p轨道处于半充满的稳定结构,故失去第一个电子较难,I1较大;
②镁离子与水之间是水分子中的氧原子提供孤电子对,镁离子提供空轨道,形成配位键,N5-与H2O之间NH-O氢键;
③ N5-为平面正五边形,N原子的杂化类型是sp2;
(3) 根据晶胞粒子的排布,确定晶胞中微粒的个数,根据ρ=![]() 计算
计算
(1)镍的原子序数为28,则基态Ni3+的价电子排布式为3d7;银与铜位于同一族,银元素位于元素周期表的ds区;
(2)①X最外层为2个电子,X为镁,N的2p轨道处于半充满的稳定结构,故失去第一个电子较难,I1较大,则Z是氮元素,Y是氧元素;
②镁离子与水之间是水分子中的氧原子提供孤电子对,镁离子提供空轨道,形成配位键,N5-与H2O之间NH-O氢键;
③ N5-为平面正五边形,N原子的杂化类型是sp2;N4-中每一个氮原子的sp2杂化轨道有2个形成σ键,一个是孤电子对,还有一个垂直于氮原子形成平面的p轨道,只有1个电子,p轨道间形成1个大π键,N4-得到1个电子,故电子数是5个,则N4-中的大π键应表示为![]() ;
;
(3)Ag+周围距离最近的Ag+有12个。1个晶胞中含有4个Ag+,4个N5-,1个晶胞的体积为(2a×10-7)cm3,则AgN5的密度可表示为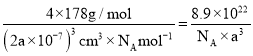 。
。


科目:高中化学 来源: 题型:
【题目】下列实验原理及操作中,正确的是
A.用酒精做萃取剂萃取碘水中的碘单质
B.配制![]() 溶液时,将称好的
溶液时,将称好的![]() 固体直接放入容量瓶中溶解
固体直接放入容量瓶中溶解
C.向某溶液中滴加![]() 溶液,有白色沉淀,再滴加足量稀HCl,若沉淀不溶解,则说明原溶液中一定含
溶液,有白色沉淀,再滴加足量稀HCl,若沉淀不溶解,则说明原溶液中一定含![]()
D.在某试样中加入NaOH溶液,加热,产生能使湿润的红色石蕊试液变蓝的气体即证明试样中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷是一种能自燃的单质,其分子的球棍模型如图所示:![]() ,下列叙述错误的是( )
,下列叙述错误的是( )
A.每个磷原子的价层电子对数为4,磷原子均为sp3杂化
B.每个磷原子形成3个σ键,磷原子为sp2杂化
C.1mol白磷中共含6mol非极性键
D.白磷的分子构型为正四面体形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式,下列推断正确的是( )
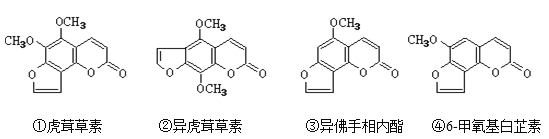
A.②中所含官能团种类比③中多
B.①、④互为同系物
C.①、②、③、④均能与氢氧化钠溶液反应
D.等物质的量②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯可被臭氧分解,发生化学反应![]() ,二甲苯通过上述反应可能的产物为
,二甲苯通过上述反应可能的产物为![]() ,若邻二甲苯进行上述反应,对其反应产物描述正确的是
,若邻二甲苯进行上述反应,对其反应产物描述正确的是
A. 产物为a、b、c,其分子个数比为a∶b∶c=1∶2∶3
B. 产物为a、b、c,其分子个数比为a∶b∶c=1∶2∶1
C. 产物为a和c,其分子个数比为a∶c=1∶2
D. 产物为b和c,其分子个数比为b∶c=2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N和Si能形成多种高硬度材料,如![]() 、
、![]() 、SiC
、SiC

(1)![]() 和
和![]() 中硬度较高的是______,理由是______。
中硬度较高的是______,理由是______。
(2)![]() 和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
(3)![]() 和N能形成一种五元环状有机物咪唑
和N能形成一种五元环状有机物咪唑![]() 简写为
简写为![]() ,其结构为
,其结构为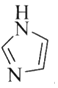
![]() 化合物
化合物![]() 的结构示意图如图2:
的结构示意图如图2:
①阳离子![]() 和
和![]() 之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。
之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。![]() 例如水中氢键的表示式为
例如水中氢键的表示式为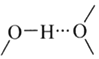
![]()
②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”,如
键”,如![]() 分子中存在“离域
分子中存在“离域![]() 键”
键”![]() ,则im分子中存在的“离域
,则im分子中存在的“离域![]() 键”是______。
键”是______。
(4)![]() 为立方晶系晶体,该晶胞中原子的坐标参数为
为立方晶系晶体,该晶胞中原子的坐标参数为
C:![]() ;
;![]() ;
;![]() 0,
0,![]() ,
,![]() ;
;![]() ;
;![]()
Si:![]() ;
;![]() ;
;![]() ;
;![]()
则![]() 立方晶胞中含有______个Si原子、______个C原子。
立方晶胞中含有______个Si原子、______个C原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用.回答下列问题:
(1)![]() 的名称是三硝酸六尿素合铁
的名称是三硝酸六尿素合铁![]() Ⅲ
Ⅲ![]() ,是一种重要的配合物.该化合物中
,是一种重要的配合物.该化合物中![]() 的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___
的核外电子排布式为____,所含非金属元素的电负性由大到小的顺序为___![]() 碳原子为____杂化,
碳原子为____杂化,![]() 的空间构型为_____.
的空间构型为_____.
(2)尿素分子中![]() 键
键![]() 键的数目之比_____.
键的数目之比_____.
(3)目前发现的铝原子簇![]() 的性质与卤素相似,则原子簇
的性质与卤素相似,则原子簇![]() 属于____晶体.
属于____晶体.![]() 存在的化学键有_____
存在的化学键有_____![]() 填字母
填字母![]() .
.
A.离子键 ![]() 极性键
极性键 ![]() 非极性键
非极性键 ![]() 配位键
配位键 ![]() 氢键
氢键 ![]() 金属键
金属键
(4)已知: ,反应后,
,反应后,![]() 键_____,
键_____,![]() 键_____
键_____![]() 填“增加”或“减少”
填“增加”或“减少”![]() .
.
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”,如
键”,如![]() 分子中存在“离域
分子中存在“离域![]() 键”,可表示成
键”,可表示成![]() ,则
,则![]()
![]() 咪唑
咪唑![]() 中的“离域
中的“离域![]() 键”可表示为_________
键”可表示为_________
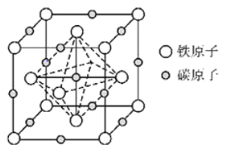
(6)奥氏体是碳溶解在![]() 中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为
中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示.若晶体密度为![]() ,则晶胞中最近的两个碳原子之间的距离为______
,则晶胞中最近的两个碳原子之间的距离为______![]() 阿伏加德罗常数的值用
阿伏加德罗常数的值用![]() 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是

A.水浴加热的优点是使反应物受热均匀、容易控制温度
B.反应完全后,可用仪器a、b蒸馏得到产品
C.实验过程中若发现仪器b中未加入碎瓷片,可冷却后补加
D.将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸, 待冷却至室温后,将所得混合物加入苯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
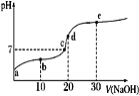
A. a点溶液的c(H+)=4×10-4mol·L-1
B. 水电离程度:e>d>c>b>a
C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D. d点:c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com