
【题目】C、N和Si能形成多种高硬度材料,如![]() 、
、![]() 、SiC
、SiC

(1)![]() 和
和![]() 中硬度较高的是______,理由是______。
中硬度较高的是______,理由是______。
(2)![]() 和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
和N能形成一种类石墨结构材料,其合成过程如图1所示。该类石墨结构材料化合物的化学式为______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有______。
(3)![]() 和N能形成一种五元环状有机物咪唑
和N能形成一种五元环状有机物咪唑![]() 简写为
简写为![]() ,其结构为
,其结构为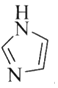
![]() 化合物
化合物![]() 的结构示意图如图2:
的结构示意图如图2:
①阳离子![]() 和
和![]() 之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。
之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:______。![]() 例如水中氢键的表示式为
例如水中氢键的表示式为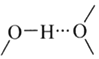
![]()
②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”,如
键”,如![]() 分子中存在“离域
分子中存在“离域![]() 键”
键”![]() ,则im分子中存在的“离域
,则im分子中存在的“离域![]() 键”是______。
键”是______。
(4)![]() 为立方晶系晶体,该晶胞中原子的坐标参数为
为立方晶系晶体,该晶胞中原子的坐标参数为
C:![]() ;
;![]() ;
;![]() 0,
0,![]() ,
,![]() ;
;![]() ;
;![]()
Si:![]() ;
;![]() ;
;![]() ;
;![]()
则![]() 立方晶胞中含有______个Si原子、______个C原子。
立方晶胞中含有______个Si原子、______个C原子。
【答案】![]() 两者同属原子晶体
两者同属原子晶体![]() 或两者结构相似
或两者结构相似![]() ,C的原子半径小于Si,与
,C的原子半径小于Si,与![]() 相比,
相比,![]() 的键长短、键能大
的键长短、键能大 ![]()
![]() 、
、![]()
![]()
![]() 4 4
4 4
【解析】
![]() 二者均为原子晶体,原子半径越小,共价键键长越短,键能越大,硬度越大;
二者均为原子晶体,原子半径越小,共价键键长越短,键能越大,硬度越大;
![]() 环上N原子形成2个
环上N原子形成2个![]() 键、含有1对孤电子对,氨基中N原子形成3个
键、含有1对孤电子对,氨基中N原子形成3个![]() 键、含有1对孤电子对,杂化轨道数目分别为3、4;
键、含有1对孤电子对,杂化轨道数目分别为3、4;
![]() 原子与N原子连接的H原子之间形成氢键;
原子与N原子连接的H原子之间形成氢键;
![]() 五个原子上的6个p电子参与形成离域
五个原子上的6个p电子参与形成离域![]() 键;
键;
![]() 由C、Si参数可知,C原子处于晶胞的顶点、面心。Si处于晶胞内部,且Si与周围最近的4个C原子形成正四面体结构,将金刚石晶胞内部的碳原子替换为Si即为
由C、Si参数可知,C原子处于晶胞的顶点、面心。Si处于晶胞内部,且Si与周围最近的4个C原子形成正四面体结构,将金刚石晶胞内部的碳原子替换为Si即为![]() 晶胞结构。
晶胞结构。
![]() 原子晶体中,成键的原子半径越小,则键长越小、键能越大,其硬度就越大。所以
原子晶体中,成键的原子半径越小,则键长越小、键能越大,其硬度就越大。所以![]() 和
和![]() 中硬度较高的是
中硬度较高的是![]() 原因是两者同属原子晶体,C的原子半径小于Si,与
原因是两者同属原子晶体,C的原子半径小于Si,与![]() 相比,
相比,![]() 的键长短、键能大;
的键长短、键能大;
![]() 由结构可知,每个碳原子与3个氮原子形成2个单键和1个双键,由于氮元素的非金属性强于碳元素,故碳元素显
由结构可知,每个碳原子与3个氮原子形成2个单键和1个双键,由于氮元素的非金属性强于碳元素,故碳元素显![]() 价、氮元素显
价、氮元素显![]() 价,由此可判断出该化合物的化学式为
价,由此可判断出该化合物的化学式为![]() 三聚氰胺的环中N原子形成2个
三聚氰胺的环中N原子形成2个![]() 键,含有1对孤电子对,杂化轨道数目为3,采取
键,含有1对孤电子对,杂化轨道数目为3,采取![]() 杂化,氨基中N原子形成3个
杂化,氨基中N原子形成3个![]() 键,含有1对孤电子对,杂化轨道数目为4,采取
键,含有1对孤电子对,杂化轨道数目为4,采取![]() 杂化;
杂化;
![]() 氢键发生在非金属强的原子和氢原子之间,在该物质中氢键可表示为
氢键发生在非金属强的原子和氢原子之间,在该物质中氢键可表示为![]() ;
;
![]()
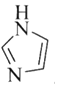 分子中三个C原子采取
分子中三个C原子采取![]() 杂化,每个C原子都有1个p电子,形成3个
杂化,每个C原子都有1个p电子,形成3个![]() 键的N原子采取
键的N原子采取![]() 杂化,含有1对p电子,形成2个
杂化,含有1对p电子,形成2个![]() 键的N原子采取
键的N原子采取![]() 杂化,含有1个p电子,五个原子上的6个p电子参与形成离域
杂化,含有1个p电子,五个原子上的6个p电子参与形成离域![]() 键,可表示为
键,可表示为![]() ;
;
![]() 从该晶胞中原子的坐标参数可知,碳原子位于晶胞的8个顶点和6个面心。每个顶点参与形成8个晶胞,每个面心参与形成2个晶胞,根据均摊法可以计算出一个晶胞中有4个碳原子,而4个硅原子位于晶胞内部,所以SiC立方晶胞中含有4个Si原子、4个C原子。
从该晶胞中原子的坐标参数可知,碳原子位于晶胞的8个顶点和6个面心。每个顶点参与形成8个晶胞,每个面心参与形成2个晶胞,根据均摊法可以计算出一个晶胞中有4个碳原子,而4个硅原子位于晶胞内部,所以SiC立方晶胞中含有4个Si原子、4个C原子。


科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一——黑火药,它的爆炸反应为2KNO3+3C+S![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
(1)除S外,上列元素的电负性从大到小依次为________。
(2)在生成物中,A的晶体类型为________,含极性共价键的分子的中心原子轨道杂化类型为________。
(3)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图Ⅱ表示常温下,0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲线
C. 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<c
D. 图Ⅳ表示反应4CO(g)+2NO2(g ) ![]() N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的价电子轨道表示式___,3d能级上的未成对的电子数为___。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③氨的沸点_______(“高于”或“低于”)膦(PH3),原因是______。
(3)单质铜及镍都是由__键形成的晶体:元素同与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是___。
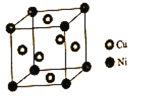
(4)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为___。
②若合金的密度为dg/cm3,晶胞参数a=____nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年3月南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Ni3+的价电子排布式为________;银与铜位于同一族,银元素位于元素周期表的________区。
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体结构如图1所示:
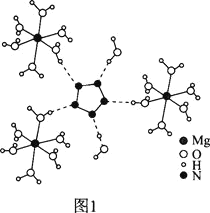
![]() 、O、Mg元素的前3级电离能如下表所示:
、O、Mg元素的前3级电离能如下表所示:
元素 | I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 |
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
X、Y、Z中为N元素的是________,判断理由是________。
②从作用力类型看,Mg2+与H2O之间是________、N5-与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是________。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如苯分子中的大
如苯分子中的大![]() 键可表示为
键可表示为![]() ,则N4-中的大
,则N4-中的大![]() 键应表示为________。
键应表示为________。
(3)AgN5的立方晶胞结构如图2所示:
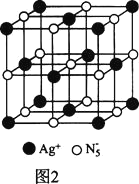
Ag+周围距离最近的Ag+有________个。若晶体中紧邻的N5-与Ag+的平均距离为anm,NA表示阿伏加德罗常数的值,则AgN5的密度可表示为________gcm-3用含a、NA的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中A、B、C、D、E为短周期主要族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外p电子数比s电子数少1 |
C元素基态原子p轨道有两个未成对电子 |
D原子的第一至第四电离能分别是: Ⅰ1=738kJ·mol-1;Ⅰ2=1451kJ·mol-1;Ⅰ3=7733kJ·mol-1;Ⅰ4=10540kJ·mol-1; |
E原子核外所有p轨道全满或半满 |
F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外最子排布为了![]() ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。
(2)B元素的电负性_____(填“大于”、“小于”或“等于”)C元素的电负性。
(3)C与D形成的化合物所含有的化学键类型为_____________。
(4)E基态原子中能量最高的电子,其电子云在空间有__________个方向。
(5)下列关于F原子的价层电子排布图正确的是___________。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(6)基态F3+离子核外电子排布式为_____________。过量单质F与B的最高价氧化物的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为____________。
(7)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外化学兴趣小组欲从铝土矿中提取少量的Al2O3,查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
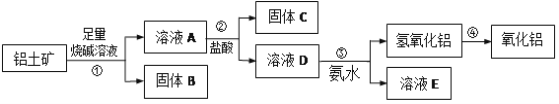
(1)固体B的主要用途为(只写一种即可)______;
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应。发生反应的离子方程式是:______
(3)第③步的实验操作名称是______,请简述洗涤的操作过程______。若往A溶液中通入足量CO2,产生的沉淀为______(填化学式);
(4)工业上制取AlCl3常用Al2O3与炭、Cl2在高温条件下反应,已知每消耗0.5mol炭单质,转移1mol电子,则该反应的化学方程式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是

A.图①表示25℃时,用0.1mol/L盐酸滴定20mL0.1mol/LNaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线
B.图②表示一定条件下进行的反应2SO2(g)+O2(g)![]() 2SO3(g)△H<O各成分的物质的量变化.t2时刻改变的条件可能是降低温度或缩小容器体积
2SO3(g)△H<O各成分的物质的量变化.t2时刻改变的条件可能是降低温度或缩小容器体积
C.图③表示某明矶溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(0H)2溶液体积的关系,在加入20mL溶液时铝离子恰好沉淀完全
D.图④表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=+183kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
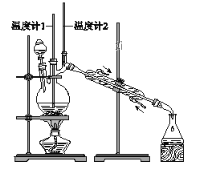
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com