
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图:
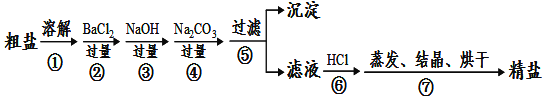
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是______。
(2)第②步操作的目的是除去粗盐中的______(填化学式,下同),第⑥步操作的目的是除去滤液中______。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、______(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是______。
(5)实验所得精盐的质量大于粗盐中NaCl的质量,原因是______。
【答案】加快粗盐溶解 Na2SO4 NaOH、Na2CO3 CaCO3、BaCO3 会引入K+ 在提纯过程中生成了氯化钠
【解析】
由题给流程图可知,第①步为粗盐溶解操作;第②步操作加入过量BaCl2溶液的目的是除去粗盐中的Na2SO4,但同时引入了BaCl2杂质;第③步操作加入过量NaOH溶液的目的是除去粗盐中MgCl2,但同时引入了NaOH杂质;第④步操作加入过量的Na2CO3溶液的目的是除去粗盐中的氯化钙和过量的氯化钡,但同时引入了Na2CO3杂质;第⑤步过滤操作,得到含有氢氧化钠和碳酸钠杂质的氯化钠溶液;第⑥步操作加入适量盐酸的目的是除去滤液中过量的氢氧化钠和碳酸钠杂质;第⑦步操作为蒸发、结晶、烘干得到精盐。
(1)在第①步粗盐溶解操作中用玻璃棒搅拌,加速了液体的流动,使固体很快溶解,故答案为:加快粗盐溶解;
(2)第②步操作加入过量BaCl2溶液的目的是除去粗盐中的Na2SO4;第⑥步操作的目的是除去滤液中过量的氢氧化钠和碳酸钠杂质,故答案为:Na2SO4;NaOH、Na2CO3;
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、第②步操作生成的BaSO4、第③步操作生成的Mg(OH)2、第④步操作生成的CaCO3和BaCO3,故答案为:CaCO3、BaCO3;
(4)在第③步操作中,选择的除杂的试剂不能用KOH溶液代替NaOH溶液,若用KOH溶液代替除去粗盐中MgCl2的同时,还会引入难以除去的K+,使得氯化钠中混有氯化钾,故答案为:会引入K+;
(6)第⑥步操作加入适量盐酸时,盐酸与氢氧化钠和碳酸钠反应生成氯化钠,使得精盐的质量大于粗盐中NaCl的质量,故答案为:在提纯过程中生成了氯化钠。


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)下列物质中,属于强电解质的是___,属于弱电解质的是__,属于非电解质的是__。(填序号)
①氨气 ②醋酸钠 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥氢氟酸 ⑦乙醇
(2)一定条件下,醋酸溶液存在电离平衡:CH3COOH![]() CH3COO-+H+ΔH>0
CH3COO-+H+ΔH>0
①下列方法中,可使0.10mol·L-1醋酸溶液中CH3COOH电离平衡向左移的是___。
a.加入少量0.10mol·L-1的稀盐酸 b.加热
c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸
②已知在25℃时,醋酸和亚硫酸的电离平衡常数分别为:醋酸:K=1.75×10-5,亚硫酸:K1=1.54×10-2 K2=1.02×10-7,则25℃时,相同浓度醋酸和亚硫酸溶液的酸性强弱:CH3COOH___H2SO3(填“>”、“<”或“=”)。
③25℃时,向0.10mol·L-1CH3COOH溶液中加入少量盐酸,使溶液中[OH-]=5.0×10-13mol·L-1,则该溶液的pH=__。(已知:lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙醇为原料,用下述6种类型的反应:①氧化,②消去,③加成,④酯化,⑤水解,⑥加聚,来合成乙二酸乙二酯(![]() )的正确顺序是( )
)的正确顺序是( )
A. ①⑤②③④B. ①②③④⑤
C. ②③⑤①⑥D. ②③⑤①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关气体体积的叙述正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12g铁粉加入25mL 2 mol·L-1氯化铁溶液中,充分反应后,其结果是( )
A. 铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B. 往溶液中滴入无色KSCN溶液,显血红色
C. Fe2+和Fe3+的物质的量之比为5∶1
D. 氧化产物与还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯),下列说法正确的是( )
Si(纯),下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1 mol Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。某工厂以酸性工业废水(含H+、Al3+、Mg2+、Cr2O72—、SO42—)以及硫酸厂废气(SO2)为原料提取铬的工艺流程如下:
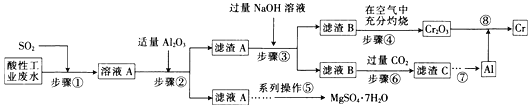
有关数据如下表所示。
化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
完全沉淀的pH | 10.5 | 4.3 | 5.3 |
开始溶解的pH | — | 7.8 | 9.2 |
Ksp近似值 | 5.6×10-12 | 1.3×10-33 | 6.3×10-31 |
请回答下列问题:
(1)步骤①中发生主要反应的离子方程式为__________________________。
(2)步骤②中加入适量Al2O3的目的是__________________________。
(3)为了达到实验目的,步骤③中加入NaOH溶液,应调节溶液的pH范围为_________。
(4)步骤⑥向滤液B中通入过量CO2,反应的离子方程式为__________________________。
(5)工业上也常采用下列装置,利用电解法处理含铬废水。
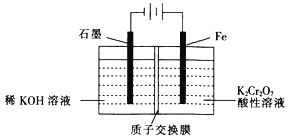
①在电解过程中阳极区pH增大的原因是_______________________。
②理论上每处理含1 mol K2Cr2O7的废水,阴极区得到的气体体积为_________(标准状况)L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 按系统命名法,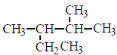 的名称为2-甲基-3-乙基丁烷
的名称为2-甲基-3-乙基丁烷
B. 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色
C. 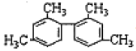 分子中至少有11个碳原子处于同一平面
分子中至少有11个碳原子处于同一平面
D. 有机物 与NaOH溶液反应,最多消耗4mol NaOH
与NaOH溶液反应,最多消耗4mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,有关说法正确的是
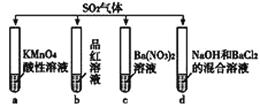
A. 试管a中实验可以证明SO2具有漂白性
B. 试管b中溶液褪色,说明SO2具有强氧化性
C. 试管c中能产生白色沉淀,该沉淀的成分为BaSO3
D. 试管d中能产生白色沉淀,该沉淀完全溶于稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com