
【题目】对于平衡体系mA(g)+nB(g) ![]() pC(g)+qD(g) ΔH<0,有下列判断,其中正确的是
pC(g)+qD(g) ΔH<0,有下列判断,其中正确的是
A. 若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m:n
B. 若温度不变,将容器的体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<p+q
C. 若平衡体系共有气体a mol,再向其中加入b mol B,当重新达到平衡时,气体的总物质的量等于(a+b),则m+n>p+q
D. 加催化剂或增大压强,可实现图3中a→b的变化
【答案】A
【解析】对于平衡体系mA(g)+nB(g) ![]() pC(g)+qD(g) ΔH<0,反应为放热反应。A. 若平衡时,A、B的转化率相等,说明A和B的变化量之比等于化学计量数之比也等于它们的起始量之比,所以反应开始时A、B的物质的量之比为m:n,A正确;B. 若温度不变,将容器的体积扩大1倍,若平衡不移动,则A的浓度会变为原来的0.5倍,因为此时A的浓度变为原来的0.6倍,说明平衡向逆反应方向移动,减小压强,化学平衡向气体分子数增多的方向移动,则m+n>p+q,B不正确;C. 若平衡体系共有气体a mol,再向其中加入b mol B,B的浓度增大,平衡必然向正反应方向移动,当重新达到平衡时,气体的总物质的量等于(a+b),说明气体的分子数不变,则m+n=p+q,C不正确;D. 加催化剂可以加快化学反应速率,减少达到平衡所用的时间,可实现图3中a→b的变化,但是增大压强不一定能实现这种变化,只有当m+n=p+q,才能实现,D不正确。本题选A。
pC(g)+qD(g) ΔH<0,反应为放热反应。A. 若平衡时,A、B的转化率相等,说明A和B的变化量之比等于化学计量数之比也等于它们的起始量之比,所以反应开始时A、B的物质的量之比为m:n,A正确;B. 若温度不变,将容器的体积扩大1倍,若平衡不移动,则A的浓度会变为原来的0.5倍,因为此时A的浓度变为原来的0.6倍,说明平衡向逆反应方向移动,减小压强,化学平衡向气体分子数增多的方向移动,则m+n>p+q,B不正确;C. 若平衡体系共有气体a mol,再向其中加入b mol B,B的浓度增大,平衡必然向正反应方向移动,当重新达到平衡时,气体的总物质的量等于(a+b),说明气体的分子数不变,则m+n=p+q,C不正确;D. 加催化剂可以加快化学反应速率,减少达到平衡所用的时间,可实现图3中a→b的变化,但是增大压强不一定能实现这种变化,只有当m+n=p+q,才能实现,D不正确。本题选A。


科目:高中化学 来源: 题型:
【题目】在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4molL﹣1和0.1molL﹣1 . 向该混合液中加入1.92g铜粉,加热,待充分反应后,设溶液的体积仍为100mL,则所得溶液中的Cu2+的物质的量浓度是( )
A.0.15 molL﹣1
B.0.225 molL﹣1
C.0.35 molL﹣1
D.0.45 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8 g该有机物燃烧生成44.0 g CO2和14.4 g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的C≡C键,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是____________。
(2)下列物质中,一定条件下能与A发生反应的是_________________。
A.H2B.Na C.酸性KMnO4溶液 D.Br2
(3)A的结构简式是________________________。
(4)有机物B是A的同分异构体,1 mol B可与1 mol Br2加成。该有机物中所有碳原子在同一个平面上,没有顺反异构现象。B的结构简式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.铁跟盐酸反应,生成氯化铁和氢气
B.四氧化三铁可以看成氧化铁和氧化亚铁组成的混合物
C.铁与灼热水蒸气反应生成氧化铁和氢气
D.铁在硫蒸气中加热后可生成FeS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的生产和生活中离不开金属材料。通常所说的“金属材料”,既包括纯金属,也包括各种合金。下列不属于合金的是( )
A. 黄铜 B. 铁锈 C. 生铁 D. 焊锡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.硫酸铁易溶于水,可用作净水剂
B.次氯酸具有弱酸性,可用作漂白剂
C.氧化钙能与水反应,可用作食品干燥剂
D.晶体硅熔点高,可用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.回答下列问题:
(1)欲量取20.00 mL KMnO4酸性溶液,应选用的仪器是________________。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、_____________、___________。
(3)在测定硫酸铜晶体中结晶水含量的实验中,称量操作至少要进行__________次。
II.氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证醛类物质的还原性。
(1)新制氢氧化铜悬浊液的配制。实验室制取氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2 mL,滴入2%的硫酸铜溶液4~6滴,振荡即成。这样操作的目的是________________________________________________________________________________。
下面是三个研究性学习小组分别从不同层面开展的研究性学习活动:
(2)研究性学习小组甲:对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究,提出猜想:_______________________________________________。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应,生成+2价的铜离子和单质铜;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣。
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称量,反复多次至固体恒重,称得质量为b g,比较a、b关系。
方案4:取该红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出。
你认为合理的方案是____________________________。
(3)研究性学习小组乙针对甲的质疑,设计新的探究方案,装置如下图所示。
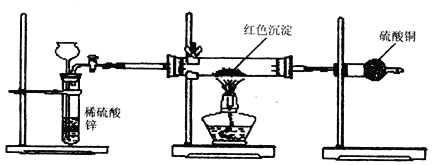
你认为要测定上述红色沉淀成分必须测定下列哪些物理量(只填序号):________________。
①通入氢气体积;②反应前,红色沉淀 + 硬质玻璃管的总质量;③完全反应后红色固体 + 硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量。
(4)研究性学习小组丙上网查阅新闻得知:“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”。绿色化学强调对环境友好,实现零排放。“变废为宝”符合绿色化学要求。他们收集上述红色沉淀制备化学试剂:蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案:____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 在25℃、101 kPa时,2 gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧热的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l) △H=-285.8kJ·mol-1
2H2O(l) △H=-285.8kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)![]() 2CO(g)+O2(g) △H=2×283.0 kJ/mol
2CO(g)+O2(g) △H=2×283.0 kJ/mol
C. 在稀溶液中:H+(aq)+OH-(aq)= H2O(l);△H =-57.3 kJ·mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D. 已知C(石墨,s) ![]() C(金刚石,s) △H=+1.9 kJ/mol,则金刚石比石墨稳定
C(金刚石,s) △H=+1.9 kJ/mol,则金刚石比石墨稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com