
【题目】下列关于浓硫酸的叙述正确的是
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸易挥发,久置浓硫酸浓度会减小
D. 浓硫酸在常温下能够使铁、铝钝化
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】标准状况下,三个烧瓶分别盛①混有空气的氨气、②等体积的二氧化氮与氧气的混合气、③二氧化氮,将它们分别倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为
A. 5:4:5 B. 1:1:1 C. 15: 12: 10 D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由 这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气 体,q的水溶液具有漂白性,r的水溶液是一种强酸,s通常是难溶于水的油状混合物。上述物质的转化关系如图所示,下列说法正确的是( )

A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是

A. P4分子中P原子均满足8电子稳定结构
B. 反应中NaOH作还原剂
C. 该反应能自发进行,则ΔS<0
D. 反应中生成1 mol NaH2PO2,转移电子数目为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A. M与R可以形成MR2型离子化合物
B. 在MR2中M的离子半径比R的离子半径大
C. 形成的两种离子分别是M+和R2-
D. MR2的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
![]()
已知转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到平衡状态
B. 若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5
D. 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
□Fe2+ +□____+□ + □H2O=□ Fe(OH)3 +□HCO3
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
操作 | 现象 | |
实验 IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副产物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
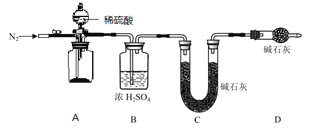
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
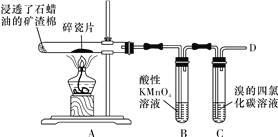
(1)A中碎瓷片的作用是____________。
(2)乙烯的电子式为__________________。
(3)下列物质中,可以通过乙烯的加成反应得到的是______(填字母代号)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)运输水果时,为了吸收水果产生的乙烯,防止水果早熟腐烂,常将浸泡有_______溶液的硅藻土放置在盛放水果的容器中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化铝和氢氧化铝的叙述错误的是( )
A.Al(OH)3受热能分解
B.Al2O3既能溶于强酸溶液又能溶于强碱溶液
C.Al(OH)3胶体能吸附水中的悬浮物
D.Al(OH)3能溶于过量的浓氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com