
【题目】与如图图像有关的叙述,正确的是( )
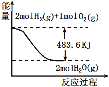
A.H2O(g)的能量低于H2(g)和O2(g)的能量之和
B.表示的热化学方程式为:H2(g)+![]() O2(g)=H2O(g)+241.8kJ
O2(g)=H2O(g)+241.8kJ
C.表示1molH2(g)完全燃烧生成水蒸气吸收241.8kJ热量
D.表示2molH2(g)所具有的能量一定比2mol气态水所具有的能量多483.6kJ
【答案】B
【解析】
由图可知,反应物总能量大于生成物总能量,为放热反应,且生成气态水。
A.根据图示可知,反应的热化学方程式为:2H2(g)+ O2(g)=2H2O(g) +483.6kJ,
反应为放热反应,2molH2(g)和1molO2(g)的能量之和高于2molH2O(g)的能量,2molH2O(g)的能量低于2molH2(g)和1molO2(g)的能量之和,故A错误;
B.根据图示可知,反应的热化学方程式为:2H2(g)+ O2(g)=2H2O(g) 483.6kJ,故表示的热化学方程式为:H2(g)+![]() O2(g)=H2O(g)+241.8kJ,故B正确;
O2(g)=H2O(g)+241.8kJ,故B正确;
C.图中表示2molH2(g)完全燃烧生成水蒸气放出483.6kJ热量,则1molH2(g)完全燃烧生成水蒸气放出241.8kJ热量,故C错误;
D.2H2(g)+ O2(g)=2H2O(g) +483.6kJ,反应为放热反应,2molH2(g)和1molO2(g)的能量之和高于2molH2O(g)的能量,能量多483.6kJ,不能表示2molH2(g)与2mol气态水的能量关系,故D错误;
答案选B。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某一溴代烷与浓NaOH的醇溶液共热时产生3种沸点不同的消去产物,该一溴代烷至少应含有________个碳原子,其中一种结构简式可表示为____________。
Ⅱ.某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为________。
(2)A中的碳原子是否都处于同一平面?________(填“是”或者“不是”);
Ⅲ.有机物A分子式为C3H6O2,把它进行实验并记录现象如下:
NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
A | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
A的结构简式为:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题。该小组设计的简单实验装置如图所示:

该实验的主要操作步骤如下:
①配制100mL1.0molL﹣1的盐酸溶液;
②用_______(填仪器名称并注明规格)量取10.0mL1.0molL﹣1的盐酸溶液加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为______;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述实验步骤④中检查装置气密性的方法:______。
(2)实验步骤⑤中应选用______(填序号)的量筒。
A.100mL B.200mL C.500mL
读数时除恢复到室温外,还要注意______。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=______,若未除去镁条表面的氧化膜,则测量结果______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】误服铊盐会导致人体急性中毒,普鲁士蓝[KFe2(CN)6]可用作铊盐的解毒剂。
(1)Fe3+的价电子轨道表示式为___,与N同周期的主族元素中,第一电离能比N大的元素有___种。
(2)普鲁士蓝与硫酸作用可形成HCN,HCN的中心原子的杂化轨道类型为___,分子的立体构型是___,分子中σ键与π键数目之比为___。
(3)普鲁士蓝中的化学键不含有___(填字母)。
a.离子键
b.共价键
C.配位键
d.金属键
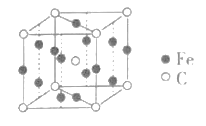
(4)已知FexCy的晶胞结构如图所示,则其化学式为___,铁原子的配位数是___。
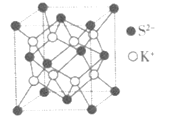
(5)如图为K2S的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是ρg·cm-3,试计算K+与S2-的最短距离为___nm(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH–;△H>0,下列叙述正确的是
H++OH–;△H>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量稀硫酸,c(H+)增大,Kw不变
D. 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一密闭容器中发生可逆反应:2E(g)![]() F(g)+xG(g) △H<0若起始时E的浓度为amol·L-1,F、G的浓度均为0,达到平衡时E的浓度为0.5amol·L-1。若起始时E的浓度为2amol·L-1,F、G的浓度均为0,达到平衡时,下列说法正确的是
F(g)+xG(g) △H<0若起始时E的浓度为amol·L-1,F、G的浓度均为0,达到平衡时E的浓度为0.5amol·L-1。若起始时E的浓度为2amol·L-1,F、G的浓度均为0,达到平衡时,下列说法正确的是
A. 升高温度时,正反应速率加快,逆反应速率减慢
B. 若x=1,容器的容积保持不变,则新平衡下E的体积分数为50%
C. 若x=2,容器的容积保持不变,则新平衡下F的平衡浓度大于0.5amol·L-1
D. 若x=2,容器内的压强保持不变,则新平衡下E的物质的量为amol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,则下列说法正确的是( )
A.常温常压下,11.2LCH4中含有的氢原子数等于2NA
B.标况下1molH2O的体积为22.4L
C.1mol Fe与足量盐酸充分反应失去电子数为3NA
D.1L 1mol·L-1K2CO3溶液中所含K+个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC将合成化学元素第115号(Mc)提名为化学新元素,Mc的原子核最外层电子数是5,下列说法不正确的( )
A. Mc的原子核外有115个电子
B. Mc与N元素属于同一主族
C. Mc在同主族元素中金属性最强
D. 中子数为173的Mc核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计用50 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1氢氧化钠溶液在如图装置中进行中和反应。试回答下列问题:
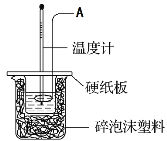
(1)仪器A的名称__________________________
(2)实验过程中下列操作正确是______________(填字母)。
A.用温度计小心搅拌
B.分多次加入氢氧化钠溶液
C.只进行一次实验,用所获得的数据计算中和热
D.用套在温度计上的A轻轻地上下搅动
(3)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=__________ (结果保留一位小数)。
(4)以下操作,会使测得的中和热ΔH发生怎样的变化?(填“偏大”“偏小”或“不变”)。
①量取稀盐酸时俯视量筒读数,测得的中和热ΔH会_______________ 。
②在中和热测定实验中未用水洗涤温度计上的盐酸直接测定碱的温度,测得的中和热ΔH会_______________。
③若用等浓度的醋酸与 NaOH 溶液反应,则测得的中和热ΔH会 __________,其原因是____________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com