
【题目】原电池原理的发现极大地推进了现代化的进程,改变了人们的生活方式。关于下图所示原电池的说法 不正确的是 ( )
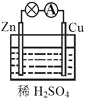
A.该装置将化学能转化为电能
B.反应一段时间后溶液的pH会增大
C.铜片上发生的反应是Cu2+ + 2e-=Cu
D.该装置使氧化反应和还原反应分别在两个不同的区域进行
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:

(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
(2)熟料溶解时,反应的离子方程式为___________________________________________。
(3)母液中溶质主要成分的化学式为_____________________________________________。
(4)将标准状况下1.12L炉气通入100mL 0.5mol·L-1NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为____________________________。
(5)检验废渣中主要成分的方法是_____________________________________________________(写出操作步骤、现象及结论)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH![]() +6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
+6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1 mol (CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.5 g;
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀;
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞溶液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①NaOH标准溶液盛放在____滴定管中,若滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮元素的质量分数________(填“偏大”“偏小”或“无影响”)。
②滴定达到终点时,酚酞指示剂由________色变成________色。
③下列有关实验操作的说法正确的是__________(双选)。
A.锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积不变
B.滴定终点时,俯视读数,使测定结果偏小
C.只能选用酚酞作指示剂
D.滴入最后一滴NaOH溶液,溶液突然变色,即为滴定终点
E.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
则所用去的NaOH标准溶液的平均体积为_______ mL,若NaOH标准溶液的浓度为0.100 0 mol·L-1,则该样品中氮元素的质量分数为___________。(列出计算式并计算结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两圆相交部分A、B、C、D分别表示两物质间的反应。下列各对应反应的离子方程式书写不正确的是( )

A.Fe+4H++NO3-=Fe3++NO↑+2H2O
B.Fe(OH)3+3H+=Fe3++3H2O
C.Fe3O4+8H+=Fe2++2Fe3++4H2O
D.3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是( )
A.HS- + H2O![]() H3O+ + S2-B.CO2 + 2H2O
H3O+ + S2-B.CO2 + 2H2O![]() HCO3- + H3O+
HCO3- + H3O+
C.NH4++H2O![]() NH3H2O + H+D.HCO3- + OH-
NH3H2O + H+D.HCO3- + OH-![]() CO32- + H2O
CO32- + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),
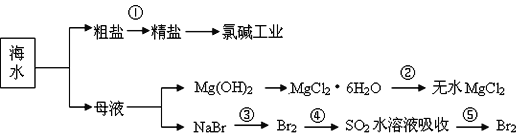
下列有关说法正确的是
A.第①步中除去粗盐中的![]() 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤→适量盐酸调pH
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤→适量盐酸调pH
B.MgSO4·7H2O在空气中加热可制得无水MgSO4的方法与第②步相似。
C.从第③步到第⑤步的目的是为了浓缩富集Br2
D.在第③④⑤步中溴元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验能力和创新意识是化学学科核心素养的重要内容之一。某研究性学习小组在验证反应“ Fe![]() ”的实验中检测到
”的实验中检测到![]() 发现和探究过程如下:向硝酸酸化的
发现和探究过程如下:向硝酸酸化的![]() 硝酸银溶液(
硝酸银溶液(![]() )中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①检验上层清液中所含离子的方法:取上层清液,滴加_________,产生蓝色沉淀,说明溶液中含有Fe2+。
②经检验黑色固体为Ag,检验方法:取出少量黑色固体,洗涤后,加入适量稀硝酸使固体溶解,再滴加__________(填试剂),产生_________(填现象)。
(2)针对“溶液呈黄色”,甲认为溶液中有![]() 乙认为铁粉过量时不可能有
乙认为铁粉过量时不可能有![]() ,乙依据的原理是______。(用离子方程式表示)o
,乙依据的原理是______。(用离子方程式表示)o
针对这两种观点继续实验:取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
I | 3 | 产生大量白色沉淀;溶液呈红色 |
II | 30 | 产生白色沉淀,较3 min时量少;溶液红色较3 min时加深 |
III | 120 | 产生白色沉淀,较30min时量少;溶液红色较30min时变浅 |
(资料: ![]() -生成白色沉淀AgSCN)
-生成白色沉淀AgSCN)
(3)实验中溶液变为红色的离子方程式为_______________,产生白色沉淀说明存在___________(填离子符号)。
(4)对![]() 产生的原因做如下假设:
产生的原因做如下假设:
假设a:可能是铁粉表面有氧化层,能产生![]()
假设b:空气中存在![]() 发生反应
发生反应![]() 产生
产生![]()
假设c:酸性溶液中的NO3-将Fe2+氧化为Fe3+
假设d:溶液存在Ag+将Fe2+氧化为Fe3+
下述实验可证实假设a、b
①实验:向硝酸酸化的__________溶液( ![]() )中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
②实验II的现象说明发生了反应__________(用离子方程式表示)。
(5)实验Ⅱ中发生的反应可以用下列装置来验证。其中甲溶液是___________,分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,_______ (“前者”或“后者”)红色更深。
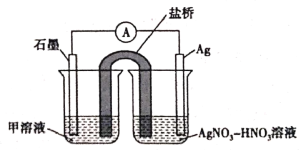
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)Fe3+的核外电子排布式_________;
(2)与CN-互为等电子体的分子是______,K4[Fe(CN)6]中的作用力除离子键和共价键外,还有_______。含有12mol σ键的K4[Fe(CN)6]的物质的量为_______mol。
(3)黄血盐中C原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________;
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是__________;
②Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 沸点:邻二甲苯>间二甲苯>对二甲苯
B. 鸡蛋淸在NH4Cl溶液中能发生盐析,但是不能和盐酸发生化学反应
C.  有机物A的分子式为C16H16O3
有机物A的分子式为C16H16O3
D.  滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com