
【题目】如图两圆相交部分A、B、C、D分别表示两物质间的反应。下列各对应反应的离子方程式书写不正确的是( )

A.Fe+4H++NO3-=Fe3++NO↑+2H2O
B.Fe(OH)3+3H+=Fe3++3H2O
C.Fe3O4+8H+=Fe2++2Fe3++4H2O
D.3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O
【答案】C
【解析】
A.稀硝酸是强氧化性酸,能将铁单质直接氧化为Fe3+,故铁和足量稀硝酸的离子方程式为:Fe+4H++NO3-═Fe3++NO↑+2H2O,故A正确;
B.Fe(OH)3中铁元素为+3价,为铁元素的最高价态,只有氧化性无还原性,故和硝酸反应时,硝酸只能体现酸性,不能体现氧化性,故离子方程式为:Fe(OH)3+3H+═Fe3++3H2O,故B正确;
C.Fe3O4中铁元素有+2价和+3价,而稀硝酸是强氧化性酸,能将Fe2+氧化为Fe3+,故正确的离子方程式为:3Fe3O4+NO3-+28H+═9Fe3++NO+14H2O,故C错误;
D.Fe(OH)2中铁元素为+2价,有较强还原性,故Fe(OH)2既有碱性又有强还原性,故和硝酸反应时,会被硝酸氧化为Fe3+,故离子方程式为:3Fe(OH)2+10H++NO3-═3Fe3++NO↑+8H2O,故D正确;
故答案为C。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】常温下,Na2CO3和NaHCO3的混合溶液中c(![]() )、c(
)、c(![]() )与pH的关系如图所示[假设c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1]。下列说法正确的是( )
)与pH的关系如图所示[假设c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1]。下列说法正确的是( )

A.图中E点溶液表示浓度均为0.05 mol·L-1的Na2CO3和NaHCO3溶液混合后所得到的溶液
B.pH=10的溶液中:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(![]() )
)
C.pH=11的溶液中:c(![]() )<c(
)<c(![]() )
)
D.向E点溶液中加入等体积0.100 mol·L-1的NaOH溶液,c(![]() )与c(
)与c(![]() )之和保持不变
)之和保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:

已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
回答下列问题
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式__________。
(2)调节pH的目的是___________,pH的调节范围为___________。
(3)生成MnCO3沉淀的离子方程式为___________。
(4)操作A为___________。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2(g)═ 2Cu2O(s)+ 2SO2(g)△H=﹣768.2kJ/mol
2Cu2O(s)+ Cu2S(s)═ 6Cu(s)+ SO2(g)△H=" +116.0" kJ/mol
则由Cu2S与O2加热反应生成Cu的热化学方程式为___________。
(6)若用含85% Cu2S(Mr=160)的辉铜矿来制备无水Cu(NO3)2,假设浸取率为95%,调节pH时损Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.6 kg这样的辉铜矿最多能制备__________mol无水Cu(NO3)2。(计算结果精确到小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO),无色气体,易溶于水,有特殊的刺微气味,对人眼、鼻等有刺激作用。40%甲醛溶液沸点为96℃,易挥发。甲醛在碱性溶液中具有极强的还原性。为探究过量甲醛和新制Cu(OH)2反应的产物成分,进行如下研究:
(1)在下图装置中进行实验,向a中加入0.5mol·L-1CuSO4溶液50mL和5 mol·L-1 NaOH溶液100mL,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。

①仪器b的名称是____________。
②仪器c的作用为____________。
③能说明甲醛具有还原性的实验现象是____________。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含H2不含CO,将装置A和如下图所示的装置连接后进行实验。

①依次连接的合理顺序为:A→B→_____→_____→_____→_____→G,________
②装置B的作用是_______________。
③确认气体产物中含H2而不含CO的现象是_________________________。
(3)已知:![]() 。证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,____________________,则说明甲醛的碳元素未被氧化成+4价。
。证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液,____________________,则说明甲醛的碳元素未被氧化成+4价。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应);

已知:ⅰ.Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) ![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
ⅱ.2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
通过上述实验,可以得出红色固体产物主要是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体A、B分别为0.6 mol和0.5 mol,在0.4 L密闭容器中发生反应:3A+BaC+2D,经5 min后,此时C为0.2mol,又知在此反应时间内,D的平均反应速率为0.1 mol·(L·min)-1,下列结论正确的是( )
A.A的平均反应速率为0.1 mol·(L·min)-1B.a值为2
C.B的转化率为50%D.此时,反应混合物总的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现极大地推进了现代化的进程,改变了人们的生活方式。关于下图所示原电池的说法 不正确的是 ( )
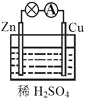
A.该装置将化学能转化为电能
B.反应一段时间后溶液的pH会增大
C.铜片上发生的反应是Cu2+ + 2e-=Cu
D.该装置使氧化反应和还原反应分别在两个不同的区域进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.由水电离出的H+浓度为1×10-9 mol/L的溶液中:Al3+、![]() 、Na+、Cl-
、Na+、Cl-
B.遇酚酞变红的溶液中:![]() 、Na+、
、Na+、![]() 、K+
、K+
C.c(![]() )=1mol/L的溶液中:H+、Fe2+、Cl-、
)=1mol/L的溶液中:H+、Fe2+、Cl-、![]()
D.pH=1的溶液中:![]() 、
、![]() 、K+、Cl-
、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A(g)和2 mol B(g)在2 L的恒容密闭容器中混合并在一定条件下发生反应:2A(g)+B(g) 2C(g) ΔH<0,反应2 s后测得C的浓度为0.6 mol·L-1。下列说法正确的是
A.2 s后物质A的转化率为70%
B.当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态
C.达到平衡状态时,增加A的物质的量,A和B的转化率都提高
D.达到平衡状态时,升高温度,平衡逆向移动,同时化学平衡常数K减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com