
【题目】氮及其化合物与工农业生产及人们的日常生活密切相关。回答下列问题:
(1)利用某废铜下脚料(主要成分是![]() )可制备硫酸铜晶体(蓝矾),制备方法如图所示:
)可制备硫酸铜晶体(蓝矾),制备方法如图所示:
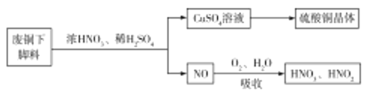
①蓝矾的化学式为:____________。
②废铜与浓硝酸,稀硫酸反应的化学方程式为______________。
(2)工业上制备尿素的反应是:![]() 。一定温度下,在容积为
。一定温度下,在容积为![]() 的恒溶液密闭容器中加入
的恒溶液密闭容器中加入![]() 和
和![]() ,反应过程中有关物质的物质的量(n)与时间的关系如图所示,
,反应过程中有关物质的物质的量(n)与时间的关系如图所示,![]() 是反应达到平衡状态。
是反应达到平衡状态。
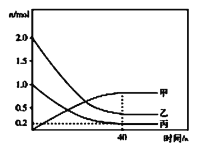
①曲线甲表示的物质是__________(写化学式)。反应开始至达到平衡时,平均反应速率![]() __________
__________![]() ,
,![]() 的平衡转化率是__________。
的平衡转化率是__________。
②升高温度,平衡__________(填“不移动”“向正反方向移动”或“向逆反应方向移动”,下同);及时从容器中分离出尿素,平衡__________。
(3)用![]() 电极作阳极可处理酸化后的亚硝酸盐污水,使
电极作阳极可处理酸化后的亚硝酸盐污水,使![]() 转化为无害气体,且溶液逐渐变为黄色,则
转化为无害气体,且溶液逐渐变为黄色,则![]() 转化为无害气体的离子方程式为__________。
转化为无害气体的离子方程式为__________。
【答案】![]()
![]()
![]() 或
或![]() 0.008
0.008 ![]() 向逆反应方向移动 不移动
向逆反应方向移动 不移动 ![]()
【解析】
(1)①蓝矾是五水合硫酸铜的俗称,据此书写化学式;②由流程图可知,![]() 与
与![]() 、
、![]() 反应只生成
反应只生成![]() ,没有生成
,没有生成![]() ,说明硝酸中的
,说明硝酸中的![]() 完全转化为
完全转化为![]() ,据此书写化学方程式;
,据此书写化学方程式;
(2)①根据曲线的特点结合化学计量数的关系分析判断曲线代表的物质,根据v=![]() 计算
计算![]() ,再结合三段式计算
,再结合三段式计算![]() 的平衡转化率;②该反应为放热反应,结合温度对平衡移动的影响分析判断平衡移动的方向;生成物
的平衡转化率;②该反应为放热反应,结合温度对平衡移动的影响分析判断平衡移动的方向;生成物![]() 为液体,结合浓度对平衡移动的影响分析判断平衡移动的方向;
为液体,结合浓度对平衡移动的影响分析判断平衡移动的方向;
(3)阳极为![]() ,失电子生成
,失电子生成![]() ,在酸性条件下能够将
,在酸性条件下能够将![]() 还原为无害的
还原为无害的![]() ,据此书写反应的离子方程式。
,据此书写反应的离子方程式。
(1)①蓝矾是五水合硫酸铜的俗称,其化学式为:CuSO45H2O,故答案为:CuSO45H2O;
②由流程图可知,![]() 与
与![]() 、
、![]() 反应只生成
反应只生成![]() ,没有生成
,没有生成![]() ,说明硝酸中的
,说明硝酸中的![]() 完全转化为
完全转化为![]() ,则化学方程式为
,则化学方程式为![]() =
=![]() ,故答案为:
,故答案为:![]() =
=![]() ;
;
(2)①曲线甲的特点是逐渐升高,则为生成物,而两种生成物的化学计量数相等,故甲为![]() 或
或![]() 。由图像中曲线的变化特点可知曲线丙为
。由图像中曲线的变化特点可知曲线丙为![]() ,则
,则![]() =
= =
=![]() 。
。

则![]() 的平衡转化率为
的平衡转化率为![]() ×100%=80%,故答案为:
×100%=80%,故答案为:![]() 或
或![]() ;0.008;80%;
;0.008;80%;
②由化学方程式![]() 可知,该反应为放热反应,升高温度,平衡向逆反应方向移动;生成物
可知,该反应为放热反应,升高温度,平衡向逆反应方向移动;生成物![]() 为液体,及时从容器中分离出尿素,不会导致平衡的移动,故答案为:向逆反应方向移动;不移动;
为液体,及时从容器中分离出尿素,不会导致平衡的移动,故答案为:向逆反应方向移动;不移动;
(3)阳极为![]() ,失电子生成
,失电子生成![]() ,该离子具有还原性,在酸性条件下能够将
,该离子具有还原性,在酸性条件下能够将![]() 还原为无害的
还原为无害的![]() ,反应的离子方程式为:
,反应的离子方程式为:![]() =
=![]() ,故答案为:
,故答案为:![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】双氧水是重要的化学试剂。
(1)一定条件下,O2得电子转化为超氧自由基(·O![]() ),并实现如下图所示的转化:
),并实现如下图所示的转化:
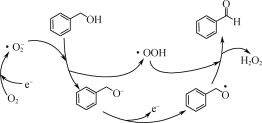
①![]() 是________(填“氧化”或“还原”)反应。
是________(填“氧化”或“还原”)反应。
②写出图示转化总反应的化学方程式:________。
(2) K2Cr2O7酸性条件下与H2O2反应生成CrO5,反应为非氧化还原反应。据此分析,CrO5中-2价O与-1价O的数目比为________。
(3) H2O2可用于测定酒精饮料中乙醇的含量。现有20.00 mL某鸡尾酒,将其中CH3CH2OH蒸出并通入17.0 mL 0.200 0 mol·L-1 K2Cr2O7溶液(H2SO4酸化)中,发生反应:K2Cr2O7+C2H5OH+H2SO4―→Cr2(SO4)3+CH3COOH+K2SO4+H2O(未配平)
再用0.400 0 mol·L-1的双氧水滴定反应后所得的混合液,用去19.00 mL双氧水,滴定过程中发生如下反应:
反应1:4H2O2+K2Cr2O7+H2SO4===K2SO4+2CrO5+5H2O
反应2:H2O2+CH3COOH===CH3COOOH+H2O
则该鸡尾酒中CH3CH2OH的物质的量浓度为________mol·L-1(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉充分反应后,得到的固体经过滤、干燥、称重,若所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42-)与c(Cl-)之比为
A.3︰14B.1︰7C.2︰7D.3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y混合气体在密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
A.平衡向右移动 B.a+b>c
C.Y的转化率提高 D.Z的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学源于生活,在生产生活中,我们会遇到各种各样的化学反应。
(1)过氧化钠用于潜水艇或呼吸面具做供氧剂,主要反应的化学方程式为:_____。
(2)工业上用电解饱和食盐水的方法生产氯气,即“氯碱工业”,写出反应的化学方程式:_____。
(3)野外作业中用于焊接铁轨,该反应的化学方程式为:_____。
(4)将一个铝制易拉罐充满CO2气体,然后往罐内注入足量的NaOH溶液,立即密封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后又重新鼓起。试用离子方程式解释易拉罐又重新鼓起的原因______。
(5)用小苏打治疗胃酸过多,反应的离子方程式为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某绝热恒容密闭容器中的反应2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0达到平衡状态,下列有关该状态时的说法中正确的是
4NO2(g)+O2(g) ΔH>0达到平衡状态,下列有关该状态时的说法中正确的是
A. N2O5,NO2,O2分子个数比为 2∶4∶1B. 混合气体的密度不再改变
C. 体系温度不再改变D. N2O5已全部转化为NO2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用SO2还原MnO2制备MnSO4的装置如图所示,下列说法正确的是( )
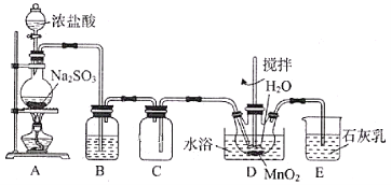
A.装置B中试剂可为Na2SO3溶液,其作用是除去SO2中的HCl
B.装置D中水浴温度应控制在80℃左右,温度过高时反应速率可能减慢
C.将装置D中所得MnSO4溶液蒸干可获得纯净的MnSO4·H2O
D.装置E中发生反应的离子方程式为SO2+2OH-=SO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 某试样焰色反应呈黄色,则试样中一定不含有![]()
B. 鉴别![]() 和
和![]() 溶液可用硝酸酸化的硝酸银溶液
溶液可用硝酸酸化的硝酸银溶液
C. 容量瓶不能用作溶解物质的容器
D. 粗盐的提纯实验中,滤液在蒸发皿中加热蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解, 至少需要1molL﹣1的盐酸的体积为( )
A. 0.05 LB. 0.1 LC. 0.2 LD. 1 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com