
【题目】航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷燃料电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-=![]() +3H2O。
+3H2O。
(1)负极上的电极反应为________。
(2)正极上的电极反应为________。
(3)消耗标准状况下的5.6 L O2时,有________ mol电子发生转移。
(4)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
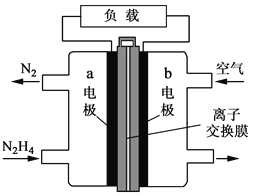
A. b极发生氧化反应
B. a极的反应式:N2H4+4OH--4e-=N2↑+4H2O
C. 放电时,电流从a极经过负载流向b极
D. 其中的离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵被广泛用于医药、干电池、织物印染、洗涤等领域。氯化铵T1温度下有以下平衡:![]()
(1)N原子最外层电子有______种运动状态;上述平衡中物质,在晶体时属于离子晶体的是__________。
(2)![]() 的电子式为______________。
的电子式为______________。
(3)Cl的非金属性强于S,用原子结构的知识说明理由:_________________。
(4)上述该反应的平衡常数表达式为____________________________________。
(5)在2L密闭容器中建立平衡,不同温度下氨气浓度变化正确的是_________。

(6)T1温度在2L,容器中,当平衡时测得![]() 为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得
为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得![]() 为bmol/L。试比较a与b的大小a_____b(填“>”“<”或“=”),并说明理由:___________。
为bmol/L。试比较a与b的大小a_____b(填“>”“<”或“=”),并说明理由:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构与性质之间有密切的关系。请回答下列问题:
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于________晶体;Ni原子和C原子之间存在________键。
(2)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③HCHO等,这些分子中C原子为sp2杂化的有________(填物质序号)。
(3)已知苯酚(![]() )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子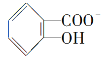 能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是_____________。
能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka2(水杨酸)________Ka(苯酚)(填“>”或“<”),其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB投入容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是 ( )
xC(g)+2D(g)。2min末测得此时容器中C和D的浓度为0.2mol/L和0.4mol/L。下列叙述正确的是 ( )
A. x=2
B. 2min时,B的浓度为0.4mol/L
C. 0~2min内B的反应速率为0.2mol·L-·min-
D. 此时A的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如图:
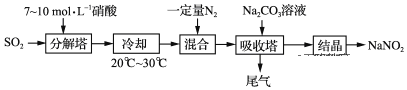
已知:Na2CO3+NO+NO2=2NaNO2+CO2
(1)“分解塔”中SO2从塔底进入,硝酸从塔顶喷淋,其目的是____。
(2)“分解塔”中的温度不宜过高,其原因是____。
(3)按一定计量比在“分解塔”中通SO2和喷入硝酸,若反应后生成的NO与NO2物质的量之比恰好1:1,则“分解塔”中发生反应的化学方程式为____。
(4)为提高氮氧化物的转化率,可向“尾气”中通入一定量的____气体,再通入“吸收塔”中,实现循环吸收。
(5)“吸收塔”所得溶液中除含有NaNO2、NaNO3和少量Na2CO3外,还含有的溶质为___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A为278g/mol。B、D、E、F、G是氧化物且B为红棕色固体,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是黄绿色气体。O是白色沉淀(图中部分反应物和生成物没有列出)。

(1)写出A、G、L的化学式A______________:G: _______________,L:______________。
(2)反应②的化学方程式 ________________________________________________。
(3)写出反应M→L的离子方程式为________________________________________。
(4)若将O敞口久置,变质过程中的现象为___________________________________,发生的化学方程式为__________________________________________________。
(5)向M溶液中投入与M等物质的量的Na2O2,反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验以探究元素性质的递变规律,实验装置如图所示.

实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律.
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,装置C中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为 ,C中可观察到的现象是 .
(2)B装置的作用是 .
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是 ,由此得出碳、硅、氮三种元素非金属性的强弱顺序是 .
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱.
(4)写出B装置中发生反应的离子方程式: .
(5)C装置的作用是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com