
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为:
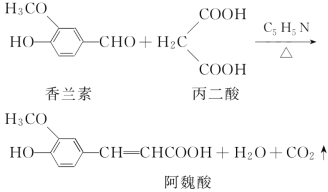
则下列说法不正确的是( )
A.丙二酸与乙二酸互为同系物
B.由题中信息可知阿魏酸甲酯的分子式为C11H12O4
C.香兰素、阿魏酸都是芳香族化合物
D.可用溴水检测上述反应中香兰素是否完全转化
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】关于元素铬![]() 的信息如下:
的信息如下:
Ⅰ![]()
溶液中存在形式 |
|
|
|
|
颜色 | 蓝紫色 | 绿色 | 橙红色 | 黄色 |
Ⅱ![]() 为难溶于水的灰蓝色固体
为难溶于水的灰蓝色固体
Ⅲ![]() 和
和![]() 在溶液中可相互转化:
在溶液中可相互转化:![]()
室温下,初始浓度为![]() 的
的![]() 溶液中
溶液中![]() 随
随![]() 的变化如图所示,以下说法正确的是
的变化如图所示,以下说法正确的是

A.若已知![]() 与
与![]() 的学性质相似,在
的学性质相似,在![]() 溶液中逐滴加入NaOH溶液直至过量,可观察到产生灰蓝色沉淀,然后沉淀逐渐溶解形成无色溶液
溶液中逐滴加入NaOH溶液直至过量,可观察到产生灰蓝色沉淀,然后沉淀逐渐溶解形成无色溶液
B.由图可知,溶液酸性增大,![]() 的平衡转化率减小
的平衡转化率减小
C.根据A点数据,可计算出该转化反应的平衡常数为![]()
D.B点溶液中,3c![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.在t ℃时,Ag2CrO4的Ksp=1×10-9
B.X点有Ag2CrO4沉淀生成
C.通过加热蒸发可以使溶液由Y点变到Z点
D.在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点变到X点最终变到Z点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素含量居金属首位,主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ.工业上用铝土矿制备铝的某种化合物的工艺流程如图:

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:___Fe2++___ClO-+___=___Fe(OH)3↓+___C1-+___
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、___(填操作名称)、过滤、洗涤。
Ⅱ.铵明矾(NH4Al(SO4)212H2O)是常见的食品添加剂,在日常生活、生产中也占有一席之地。
(1)铵明矾可用于净水,用离子方程式表示其净水原理___;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是___。
(2)实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=___。
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___(填代号)。
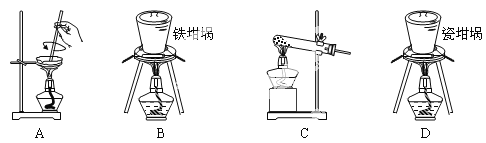
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁条、铝条平行插入一定浓度的NaOH溶液中,用导线连接构成原电池(如图所示),此电池工作时,下列叙述中正确的是( )
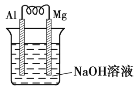
A.Mg比Al活泼,Mg失去电子被氧化成Mg2+
B.负极反应为Al-3e-+4OH-=![]() +2H2O
+2H2O
C.外电路中电子由Mg电极经导线流向Al电极
D.Al是正极,开始工作时溶液中会有白色沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:

(1)该密闭容器的容积是___。
(2)达到未平衡状态的时刻是___min(填“3”或“10”)。
(3)在前3min内,用H2浓度的变化表示的反应速率v(H2)=___mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为__。
(5)达平衡后H2O(g)的物质的量分数是___。
(6)已知:①CO(g)+2H2(g)=CH3OH(g) △H=-90.1kJ/mol,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.1kJ/mol,则CO2与H2反应合成CH3OH(g)的热化学方程式__,反应在10min内所放出的热量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“1.0 mol·L-1 NaCl溶液”的说法正确的是
A.该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B.若取该溶液50 mL,其中c(Cl-) = 0.05 mol·L-1
C.若取该溶液10 mL,恰好能与100 mL 0.1 mol·L-1 AgNO3溶液完全反应
D.该溶液与1.0 mol·L-1 Na2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸酯的分子式为C8H14O6,1mol该酯完全水解可得到2mol羧酸和1mol某常见的醇,且1mol该羧酸能与足量的钠反应放出22.4L(标准状况)H2,下列说法错误的是( )
A. 该醇是乙二醇B. 该羧酸有3种同分异构体
C. 该羧酸含有的官能团是羟基和羧基D. 该羧酸的分子式是C3H6O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com