
【题目】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
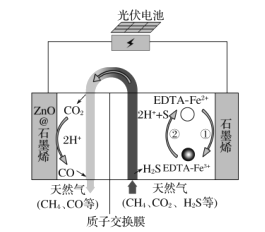
该装置工作时,下列叙述正确的是( )
A.电子从ZnO@石墨烯极移到石墨烯极,电解质中的阳离子向石墨烯极移动
B.光伏电池中使用二氧化硅把光能转为化学能
C.协同转化总反应:CO2+H2S=CO+H2O+S
D.石墨烯上的电势比ZnO@石墨烯上的低
【答案】C
【解析】
从示意图可知,ZnO@石墨烯极上由CO2→CO,故发生的电极反应为:CO2+2H++2e-=CO + H2O,是还原反应,故为阴极,石墨烯发生的电极反应为:EDTA-Fe2+- e-=EDTA-Fe3+,是氧化反应,故为阳极,再在进行解答。
A.电子从电源的负极经导线流向阴极,再从阳极经导线流向电源的正极,电解质中的阳离子由阳极流向阴极,故流向ZnO@石墨烯极,故A错误;
B.光伏电池中使用晶体硅把光能转为化学能,故B错误;
C.从示意图中可以看出,天然气中的杂质CO2再左侧转化为了CO,而H2S则在右侧转化为了S,故可以得出协同转化总反应:CO2+H2S=CO+H2O+S,故C正确;
D.石墨烯是阳极,ZnO@石墨烯是阴极,故石墨烯上的电势比ZnO@石墨烯上的高,故D错误;
故答案为:C


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,请按要求回答下列问题:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | A | |||||||
二 | D | E | G | I | ||||
三 | B | C | F | H |
(1)A-I中元素,化学性质最不活泼的是______(用元素符号),还原性最强的单质是______(用元素符号);
(2)A-I中最高价氧化物的水化物酸性最强的酸是______(用化学式);
(3)用电子式表示D元素最高价氧化物的形成过程_______________________________ ;
D元素最高价氧化物的结构式为______
(4)写出B与C两元素最高价氧化物的水化物之间反应的离子方程式___________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今化学与生产、生活密切相关。下列说法正确的是( )
A.晶体硅被用于计算机芯片,工业制粗硅的反应原理为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B.合金熔点、硬度都低于成分金属
C.中国天眼FAST用到的碳化硅是一种新型的有机高分子材料
D.无色透明的SiO2是制造光导纤维的重要原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制备氯气并进行一系列相关实验(夹持设备及必要的加热装置已省略)。
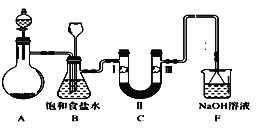
(1)整套装置装配完毕后,首先进行的操作是___,再添加试剂。
(2)实验室常用MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O制取氯气:
MnCl2+Cl2↑+2H2O制取氯气:
①实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度为____。
②标准状况下,上述反应每生成4.48L氯气,转移电子的物质的量为___mol。
(3)洗气装置B的作用是除去Cl2中的HCl气体,同时用作安全瓶(监测实验时装置C中是否发生堵塞)。若装置C发生堵塞,装置B中将观察到的现象是___。
(4)装置C的作用是验证氯气是否具有漂白性。为此,实验时装置C中I、II、III处依次放入的物质是____(填字母)。
A | B | C | D | |
I | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 无水氯化钙 | 无水氯化钙 | 浓硫酸 |
III | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(5)向品红溶液中同时通入氯气和二氧化硫(按物质的量之比1:1),观察到的现象是___。用化学方程式解释一下原因___。
(6)F为尾气吸收装置。实验时,该装置中反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.二环己烷(![]() )的二氯代物有6种结构(不考虑立体异构)
)的二氯代物有6种结构(不考虑立体异构)
B.环己烯(![]() )可以发生加成反应、加聚反应、取代反应、氧化反应。
)可以发生加成反应、加聚反应、取代反应、氧化反应。
C.分子式为C5H10O2,且属于酯的同分异构体共有8种(不考虑立体异构)
D.葡萄糖和果糖互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示装置检验乙烯时不需要除杂的是
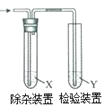
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________。A中制取Cl2的离子方程式____________________。
(2)试剂Y的名称为______________。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________;
假设2:存在三种成分:NaHCO3和__________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。_______
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。

(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ. NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) ![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=________.
2CO2(g)+N2(g) ΔH=________.
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。
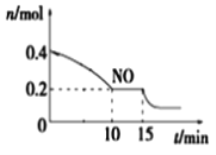
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是_____(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
Ⅱ. SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:_________________________
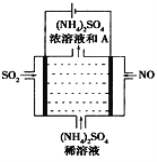
(4)如图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____________________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

(1)步骤③的实验操作名称是______。
(2)为检验提取碘后的水溶液中是否还含有单质碘,可选择的试剂是:_____。
(3)步骤④反应中能生成可溶性的Mn2+,写出该反应的离子方程式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com