
【题目】下列关于有机物的说法正确的是( )
A.二环己烷(![]() )的二氯代物有6种结构(不考虑立体异构)
)的二氯代物有6种结构(不考虑立体异构)
B.环己烯(![]() )可以发生加成反应、加聚反应、取代反应、氧化反应。
)可以发生加成反应、加聚反应、取代反应、氧化反应。
C.分子式为C5H10O2,且属于酯的同分异构体共有8种(不考虑立体异构)
D.葡萄糖和果糖互为同系物
【答案】B
【解析】
A.二环己烷(![]() )的二氯代物有7种结构,分别为
)的二氯代物有7种结构,分别为![]() 6种和
6种和![]() ,共7种,故A错误;
,共7种,故A错误;
B.环己烯(![]() )含有碳碳双键,故可以发生加成反应、加聚反应和氧化反应,与碳碳双键相邻碳原子上的氢容易被取代,故可以发生取代反应,故B正确;
)含有碳碳双键,故可以发生加成反应、加聚反应和氧化反应,与碳碳双键相邻碳原子上的氢容易被取代,故可以发生取代反应,故B正确;
C.分子式为C5H10O2,且属于酯的同分异构体共有9种,分别是HCOOCH2CH2CH2CH3、HCOOCH(CH3)CH2CH3、HCOOCH2CH(CH3)2、HCOOC(CH3)3、CH3COOCH2CH2CH3、CH3COOCH(CH3)2、CH3CH2COOCH2CH3、CH3CH2CH2COOCH3、(CH3)2CHCOOCH3,故C错误;
D.葡萄糖和果糖分子式相同,互为同分异构体,故D错误;
故答案为:B


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为____________。
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,则2CO2(g)+ 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的nCO2/nH2值变小
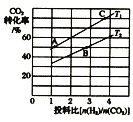
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3) =___;KA、KB、KC三者之间的大小关系为_____。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c (NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
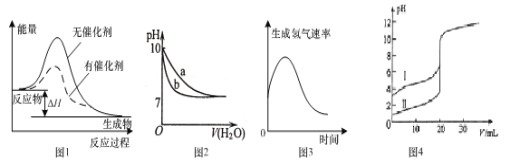
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH变化曲线,其中b表示氨水稀释时pH的变化曲线
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因能是该反应为放热反应
D.图4表示室温下,用0.l00mol ·L-1NaOH溶液分别滴定20.00 mL 0.100 mol ·L-1的盐酸和醋酸,其中I表示的是滴定盐酸的曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
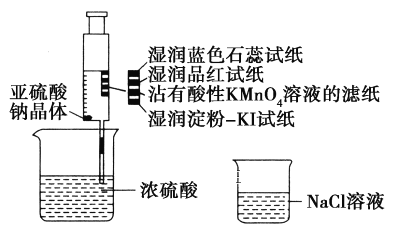
A. 蓝色石蕊试纸先变红后褪色
B. 品红试纸、沾有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性
C. 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
D. NaCl溶液可用于除去实验中多余的SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
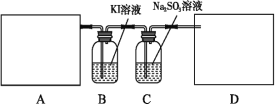
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液加热反应可制取氯气,他们设计如下实验用于制取氯气并验证其性质。
试回答:
(1)该实验中A部分的装置是___________ (填写字母)。A部分的装置中发生反应的化学方程式为:___________。
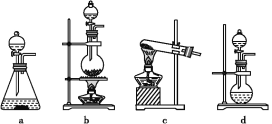
(2)B中的发生反应的离子方程式为____________。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因:___________。请你帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤)__________。
(4)请根据题意画出D处的实验装置图,并注明盛放的物质___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
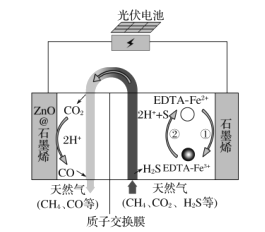
该装置工作时,下列叙述正确的是( )
A.电子从ZnO@石墨烯极移到石墨烯极,电解质中的阳离子向石墨烯极移动
B.光伏电池中使用二氧化硅把光能转为化学能
C.协同转化总反应:CO2+H2S=CO+H2O+S
D.石墨烯上的电势比ZnO@石墨烯上的低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自门捷列夫绘制第一张元素周期来以来,经过多次的演变,出现了多种形式的元素周期表,其揭示的规律在多领城发挥了重要作用。下表是元素周期表中部分短周期主族元素的有关信息:
元素编号 | 元素性质或原子结构 |
T | 核外有 5 种不同能量的电子,且最外层有 2 对成对电子 |
X | 最高化合价为+7 价 |
Y | 短周期主族元素原子中半径最大 |
Z | 最高价氧化物对应水化物具有两性 |
(1)上述四种元素中,其简单离子的半径最小的是________(填离子符号)。
(2)T 和 X 对应的元素,其气态氢化物稳定性较强的是_______(填化学式)。
(3)用原子结构的知识,说明 T 和 X 对应元素的非金属性的相对强弱。在 T 对应元素的气态氢化物,其水溶液中滴加 X 单质的水溶液,现象是_______,写出反应的离子方程式 _______。
(4)Y 和 Z 对应元素,其最高价氧化物对应水化物可发生反应。写出该反应的离子方程式________。
(5)可用 Z 对应元素的单质,与氧化铁反应来冶炼铁。若反应中生成了11.2g单质,则转移电子的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃(含一个双键)组成,在同温同压下,混合气体对氢气的相对密度13,在标准状况下,将56L混合气体通入足量的溴水中,溴水的质量增重35g。
(1)计算确定混合气体中烃的化学式_____。
(2)混合气体中两种烃的物质的量之比_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)![]() 2Z(g)+W(g);△H>0达到平衡时,VA=1.2aL,则下列说法错误的是:
2Z(g)+W(g);△H>0达到平衡时,VA=1.2aL,则下列说法错误的是:
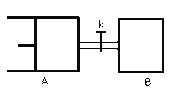
A.反应开始时,B容器中化学反应速率快
B.A容器中X的转化率为40%,且比B容器中X的转化率大
C.打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计)
D.打开K达新平衡后,升高B容器温度,A容器体积会增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com