
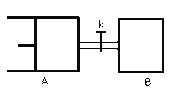
【题目】如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)![]() 2Z(g)+W(g);△H>0达到平衡时,VA=1.2aL,则下列说法错误的是:
2Z(g)+W(g);△H>0达到平衡时,VA=1.2aL,则下列说法错误的是:
A.反应开始时,B容器中化学反应速率快
B.A容器中X的转化率为40%,且比B容器中X的转化率大
C.打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计)
D.打开K达新平衡后,升高B容器温度,A容器体积会增大
【答案】C
【解析】
由图可知,A保持恒压,B保持恒容.
A. 化学反应速率与物质的浓度有关,浓度越大反应速率越大;
B. 先根据相同条件下,气体的气体之比等于物质的量之比计算平衡后气体的物质的量,再结合方程式列三段式计算X参加反应的物质的量,最后根据转化率公式计算X的转化率,再结合A装置为恒压条件,相对于B来说,A容器相当于减压,分析化学平衡移动,判断X的转化率的大小关系;
C. 根据恒温恒容条件下,气体的体积之比等于物质的量之比,已知A中充入1molX和1molY的体积为1.2aL,则打开K,相当于充入了3molX和3molY,所以AB总体积为3.6aL,从而得出A的体积;
D. 升高温度,平衡向吸热方向移动。
A. 起始VA=VB=aL,B中的物质的量大于A中的物质的量,即B装置中的浓度大于A装置中的浓度,所以反应开始时,B反应速率大于A反应速率,A项正确;
B. 恒温恒压条件下,气体的体积之比等于气体的物质的量之比,达到平衡时,VA=1.2aL,是起始时容器容积的1.2倍,所以平衡后混合气体的物质的量应为起始时混合气体物质的量的1.2倍,共2.4mol,
设A物质反应了x mol,可列出三段式
X(g) + Y(g) 2Z(g) + W(g)
起始 1mol 1mol
转化 x mol x mol 2x mol x mol
平衡 (1-x)mol (1-x)mol 2x mol x mol 则1-x+1-x+2x+x=2.4mol
解得,x=0.4mol,所以A容器中X的转化率为![]() ;A装置为恒温恒压条件,该反应向正反应方向进行时,混合气体的物质的量增大,导致A容器容积增大,相对于B来说,A容器相当于减压,而减压平衡会向气体体积增大的正反应方向移动,所以A容器中X的转化率比B大,B项正确;
;A装置为恒温恒压条件,该反应向正反应方向进行时,混合气体的物质的量增大,导致A容器容积增大,相对于B来说,A容器相当于减压,而减压平衡会向气体体积增大的正反应方向移动,所以A容器中X的转化率比B大,B项正确;
C. 当打开K时,整个装置是在恒温恒压条件下反应,使整个装置中气体的压强与A装置中的初始压强相同,向A中充入1molX和1molY达到平衡时,VA=1.2aL;当打开K时,AB中气体共为3molX和3molY,由于整个装置是在恒温恒压条件下的反应,达到平衡状态时,混合气体的体积是3.6aL,其中B是aL,所以A是3.6aLaL=2.6aL,故C错误;
D. 打开K后,装置为恒压条件,该反应是吸热反应,所以升高温度,平衡正向移动,气体物质的量增大,则容器容积增大,则A容器的体积会增大,D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.二环己烷(![]() )的二氯代物有6种结构(不考虑立体异构)
)的二氯代物有6种结构(不考虑立体异构)
B.环己烯(![]() )可以发生加成反应、加聚反应、取代反应、氧化反应。
)可以发生加成反应、加聚反应、取代反应、氧化反应。
C.分子式为C5H10O2,且属于酯的同分异构体共有8种(不考虑立体异构)
D.葡萄糖和果糖互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数的值为NA,下列说法正确的是( )
A.在常温常压下, lmol 氦气含有的原子数目为2NA
B.7. 1克氯气通入足量的氢氧化钠溶液中,转移的电子数为0.2NA
C.标准状况下,2.24L N2和O2的混合气体中原子数为0.2NA
D.标准状况下,2.24LHCl溶于500mL水中所得溶液浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列叙述正确的是![]()
![]()
A.现用清洁燃料主要有压缩天然气和液化石油气两类,它们的主要成分均属于碳氢化合物
B.为了防止月饼等富脂食品氧化变质,延长食品的保质期,常在其包装中放入生石灰
C.煤经气化和液化两个物理过程后,可变为清洁能源,这是煤综合利用的主要方法
D.棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测合理的是

A. 由①、②可知, pH越大,+2价铁越易被氧化
B. 由②、③推测,若pH>7,+2价铁更难被氧化
C. 由①、③推测,FeCl2被O2氧化的反应为放热反应
D. 60℃、pH=2.5时, 4 h内Fe2+的平均消耗速率大于 0.15a mol/(L·h)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

(1)步骤③的实验操作名称是______。
(2)为检验提取碘后的水溶液中是否还含有单质碘,可选择的试剂是:_____。
(3)步骤④反应中能生成可溶性的Mn2+,写出该反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
(资料查阅)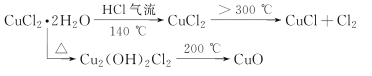
该小组用如图所示装置进行实验(夹持仪器略)
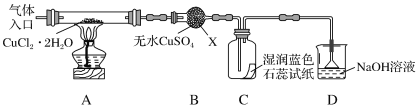
请回答下列问题:
(1)仪器X的名称是___。
(2)实验操作的先后顺序是a→___→e(填操作的编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是___。
(探究反思)
(4)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。根据资料信息
①若杂质是CuCl2,则产生的原因是___。
②若杂质是CuO,则产生的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物是重要的材料,应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
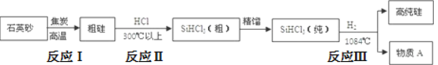
①用石英砂和焦炭高温加热时有碳化硅生成,该反应的化学方程式为______________。
②写出由纯SiHCl3制备高纯硅的化学反应方程式:________________。
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出并配平该化学反应方程式:________________。
(2)水泥属于硅酸盐工业产品,是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
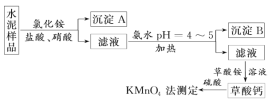
回答下列问题:
①在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是_______________,还可使用_________代替硝酸。
②沉淀A的主要成分是__________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为________。
③加氨水过程中加热的目的是_______。沉淀B的主要成分为________、_______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳甲烷化反应为:CO(g) + 3H2(g) = CH4(g) + H2O(g)。下图是使用某种催化剂时转化过程中的能量变化(部分物质省略)。
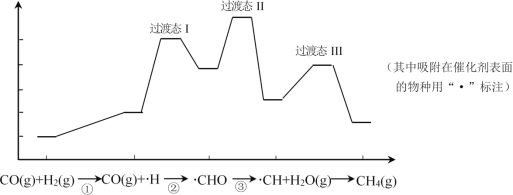
下列说法不正确的是
A.步骤①只有非极性键断裂
B.步骤②的原子利用率为 100%
C.过渡态Ⅱ能量最高,因此其对应的步骤③反应速率最慢
D.该方法可以清除剧毒气体CO,从而保护环境
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com