
【题目】一氧化碳甲烷化反应为:CO(g) + 3H2(g) = CH4(g) + H2O(g)。下图是使用某种催化剂时转化过程中的能量变化(部分物质省略)。
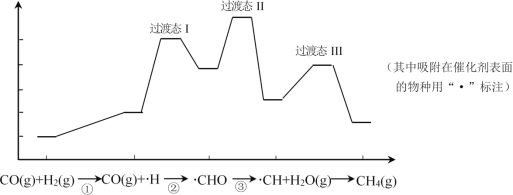
下列说法不正确的是
A.步骤①只有非极性键断裂
B.步骤②的原子利用率为 100%
C.过渡态Ⅱ能量最高,因此其对应的步骤③反应速率最慢
D.该方法可以清除剧毒气体CO,从而保护环境
科目:高中化学 来源: 题型:
【题目】如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)![]() 2Z(g)+W(g);△H>0达到平衡时,VA=1.2aL,则下列说法错误的是:
2Z(g)+W(g);△H>0达到平衡时,VA=1.2aL,则下列说法错误的是:
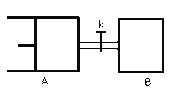
A.反应开始时,B容器中化学反应速率快
B.A容器中X的转化率为40%,且比B容器中X的转化率大
C.打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计)
D.打开K达新平衡后,升高B容器温度,A容器体积会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和乙烷的混合气体共amol,与bmol氧气共存于一密闭容器中,点燃后乙烯和乙烷充分燃烧,得到一氧化碳和二氧化碳的混合气体和45g水。
(1)一氧化碳和二氧化碳的混合气体总物质的量是_____,生成水的物质的量是____。
(2)当a=1时,乙烯和乙烷的物质的量之比是________。
(3)当a=1,且反应后一氧化碳和二氧化碳混合气体的物质的量是反应前氧气的2/3时,则b等于______,得到的一氧化碳和二氧化碳的物质的量之比是_____。
(4)a的取值范围是________,b的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做原电池原理的实验时,有如下实验步骤:
①用导线将灵敏电流计的两端分别与纯净的锌片和铜片相连接(如图1);
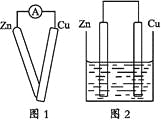
②把一块纯净的锌片插入盛有稀硫酸的烧杯中;
③把一块纯净的铜片插入盛有稀硫酸的烧杯中;
④用导线把锌片和铜片连接起来后,再平行地插入盛有稀硫酸的烧杯中(如图2)。
回答下列问题:
(1)实验步骤①中应观察到的现象是_______________________。
(2)实验步骤②中应观察到的现象是_______________________。
(3)实验步骤③中应观察到的现象是_______________________。
(4)实验步骤④中应观察到的现象是_______________________。
(5)通过实验步骤④该同学头脑中有了一个猜想(或假设),该猜想是_______。
(6)为了证实该猜想,该同学又设计了第⑤步实验,请简要画出第⑤步实验的装置示意图。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探讨浓度对化学平衡的影响,某同学对可逆反应 “2Fe3++2I-![]() 2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。
2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。

说明:0.005 mol·L-1的Fe2(SO4)3溶液颜色接近于无色。
(1)实验中要待实验Ⅰ溶液颜色不再改变时,才能进行实验Ⅱ,目的是 。
(2)实验Ⅱ中,ⅰ的现象是 ,该实验证明 。
(3)实验Ⅱ中,ⅲ的化学平衡向 移动(填“正反应方向”或“逆反应方向”);ⅲ的现象是溶液变浅,该现象 (填“能”或“不能”)说明化学平衡发生移动。如果前一空填“能”,则下一空不填;如果前一空填“不能”,则ⅲ的目的是 。
(4)实验Ⅱ中,ⅱ的现象是 ,即能证明增大生成物浓度化学平衡发生了逆向移动。
(5)除了上图中的方法外,若要使该可逆反应的化学平衡逆向移动,还可以采用的方法有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 的资源化利用能有效减少 CO2 排放,充分利用碳资源。
⑴在海洋碳循环中,通过如图所示的途径固碳。
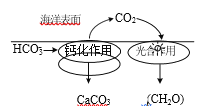
①写出钙化作用的离子方程式_____。
②同位素示踪法证实光合作用释放出的O2 只来自于H2O。用18O标记物质的光合作用的化学方程式如下,将其补充完整:
______________+________________![]()
⑵电解法转化 CO2 可实现 CO2 资源化利用。电解 CO2 制 HCOOK 的原理示意图如下。
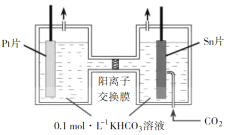
①阴极的电极反应式为_____。
②电解一段时间后,阳极区KHCO3 浓度下降,原因是______________________________________。
⑶CO2 催化加氢合成二甲醚是一种 CO2 转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g) + H2(g) === CO(g) + H2O(g) ΔH = +41.2 kJ·mol1
反应Ⅱ:2CO2(g) + 6H2(g) === CH3OCH3(g) + 3H2O(g) ΔH = 122.5 kJ·mol1
在恒压、CO2 和H2 的起始量一定的条件下,CO2 平衡转化率和平衡时 CH3OCH3 的选择性随温度的变化如图。
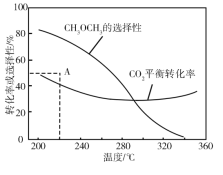
CH3OCH3 的选择性 =2CH3OCH3的物质的量反应的CO2的物质的量×100%
①温度高于300 ℃时,CO2 平衡转化率随温度升高而上升的原因是____________。
②220℃时,在催化剂作用下 CO2 与H2 反应一段时间后,测得 CH3OCH3 的选择性为48%(图中 A 点)。反应时间和温度不变,提高 CH3OCH3 选择性的措施有_________________。
A.增大压强 B. 使用对反应Ⅱ催化活性更高的催化剂 C. 及时移走产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)( )
A.所得溶液中c(Cu2+)=0.225mol/L B.所得溶液中c(Cu2+)=0.03mol/L
C.所得气体在标准状况下的体积为0.448L D.反应中转移0.06mol的电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com