
【题目】CO2 的资源化利用能有效减少 CO2 排放,充分利用碳资源。
⑴在海洋碳循环中,通过如图所示的途径固碳。
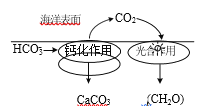
①写出钙化作用的离子方程式_____。
②同位素示踪法证实光合作用释放出的O2 只来自于H2O。用18O标记物质的光合作用的化学方程式如下,将其补充完整:
______________+________________![]()
⑵电解法转化 CO2 可实现 CO2 资源化利用。电解 CO2 制 HCOOK 的原理示意图如下。
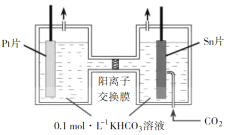
①阴极的电极反应式为_____。
②电解一段时间后,阳极区KHCO3 浓度下降,原因是______________________________________。
⑶CO2 催化加氢合成二甲醚是一种 CO2 转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g) + H2(g) === CO(g) + H2O(g) ΔH = +41.2 kJ·mol1
反应Ⅱ:2CO2(g) + 6H2(g) === CH3OCH3(g) + 3H2O(g) ΔH = 122.5 kJ·mol1
在恒压、CO2 和H2 的起始量一定的条件下,CO2 平衡转化率和平衡时 CH3OCH3 的选择性随温度的变化如图。
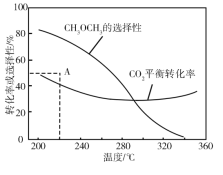
CH3OCH3 的选择性 =2CH3OCH3的物质的量反应的CO2的物质的量×100%
①温度高于300 ℃时,CO2 平衡转化率随温度升高而上升的原因是____________。
②220℃时,在催化剂作用下 CO2 与H2 反应一段时间后,测得 CH3OCH3 的选择性为48%(图中 A 点)。反应时间和温度不变,提高 CH3OCH3 选择性的措施有_________________。
A.增大压强 B. 使用对反应Ⅱ催化活性更高的催化剂 C. 及时移走产物
【答案】Ca2+ + 2HCO3- = CaCO3 ↓+ CO2↑+ H2O xCO2 2xH2O CO2 + 2e- + H2O =HCOO- + OH- 氢氧根与碳酸氢根反应生成碳酸根和水 反应Ⅰ是吸热反应,反应向吸热反应方向移动即正向移动,反应Ⅱ是放热反应,升高温度,平衡向吸热反应方向移动即逆向移动,升高温度,对反应Ⅱ的影响大于反应Ⅰ,因此CO2平衡转化率随温度升高而上升 ABC
【解析】
⑴①钙化作用是钙离子和碳酸氢根反应生成碳酸钙、二氧化碳和水;②根据质量守恒配平反应。
⑵①电解 CO2 制 HCOOK,化合价降低,在阴极反应;②分析阴极产物与碳酸氢根反应。
⑶①根据图中信息,温度高于300℃时,分析两个反应在改变温度时平衡移动谁占主要;②根据平衡移动原理及存在两个竞争的反应来分析提高CH3OCH3选择性的措施。
⑴①钙化作用是钙离子和碳酸氢根反应生成碳酸钙、二氧化碳和水,其离子方程式Ca2+ + 2HCO3- = CaCO3 ↓+ CO2↑+ H2O;故答案为:Ca2+ + 2HCO3- = CaCO3 ↓+ CO2↑+ H2O。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,根据质量守恒得到化学方程式xCO2 + 2xH2O![]() ;故答案为:xCO2 ;2xH2O。
;故答案为:xCO2 ;2xH2O。
⑵①电解 CO2 制 HCOOK,化合价降低,在阴极反应,因此阴极的电极反应式为CO2 + 2e- + H2O =HCOO- + OH-;故答案为:CO2 + 2e- + H2O =HCOO- + OH-。
②阴极生成氢氧根,氢氧根与碳酸氢根反应生成碳酸根和水,因此电解一段时间后,阳极区KHCO3 浓度下降;故答案为:氢氧根与碳酸氢根反应生成碳酸根和水。
⑶①根据图中信息,温度高于300℃时,CO2平衡转化率随温度升高而上升的原因是反应Ⅰ是吸热反应,反应向吸热反应方向移动即正向移动,反应Ⅱ是放热反应,升高温度,平衡向吸热反应方向移动即逆向移动,升高温度,对反应Ⅱ的影响大于反应Ⅰ,因此CO2平衡转化率随温度升高而上升;故答案为:反应Ⅰ是吸热反应,反应向吸热反应方向移动即正向移动,反应Ⅱ是放热反应,升高温度,平衡向吸热反应方向移动即逆向移动,升高温度,对反应Ⅱ的影响大于反应Ⅰ,因此CO2平衡转化率随温度升高而上升。
②A. 反应Ⅱ是体积减小的反应,而反应Ⅰ是等体积反应,增大压强,反应Ⅱ平衡正向移动,提高CH3OCH3选择性;B. 反应存在两个竞争的反应,因此使用对反应Ⅱ催化活性更高的催化剂来提高CH3OCH3选择性;C. 及时移走产物CH3OCH3,能使得反应Ⅱ不断正向反应,增加CH3OCH3选择性;综上所述,答案为ABC。


科目:高中化学 来源: 题型:
【题目】硅及其化合物是重要的材料,应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
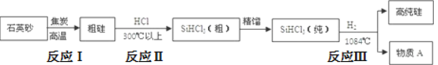
①用石英砂和焦炭高温加热时有碳化硅生成,该反应的化学方程式为______________。
②写出由纯SiHCl3制备高纯硅的化学反应方程式:________________。
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出并配平该化学反应方程式:________________。
(2)水泥属于硅酸盐工业产品,是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
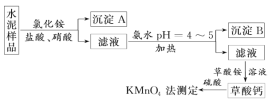
回答下列问题:
①在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是_______________,还可使用_________代替硝酸。
②沉淀A的主要成分是__________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为________。
③加氨水过程中加热的目的是_______。沉淀B的主要成分为________、_______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳甲烷化反应为:CO(g) + 3H2(g) = CH4(g) + H2O(g)。下图是使用某种催化剂时转化过程中的能量变化(部分物质省略)。
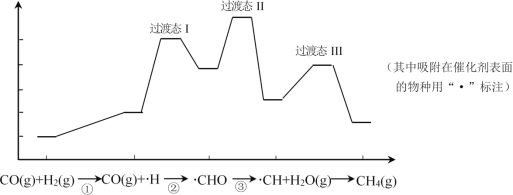
下列说法不正确的是
A.步骤①只有非极性键断裂
B.步骤②的原子利用率为 100%
C.过渡态Ⅱ能量最高,因此其对应的步骤③反应速率最慢
D.该方法可以清除剧毒气体CO,从而保护环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200mL 1molL—1的氯化铝溶液中加入一定体积的2molL—1的NaOH溶液,最终产生7.8g沉淀,则加入的NaOH溶液的体积可能为
①350mL ②90mL ③150mL ④200mL
A. 只有① B. ①③ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 2SiHCl3(g)![]() SiH2Cl2(g) + SiCl4(g)在催化剂作用下,于 323 K 和 343 K 时充分反应,SiHCl3 的转化率随时间变化的结果如图所示:
SiH2Cl2(g) + SiCl4(g)在催化剂作用下,于 323 K 和 343 K 时充分反应,SiHCl3 的转化率随时间变化的结果如图所示:
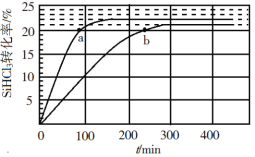
下列说法不正确的是
A.343 K 时反应物的平衡转化率为 22%
B.a、b 处反应速率大小:va>vb
C.要提高 SiHCl3 转化率,可采取的措施是降温和及时移去反应产物
D.已知反应速率![]() ,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,则 343 K 时
,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,则 343 K 时 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。将混合气体依次通过如图装置,最后收集在气球中。下列结论不正确的是( )
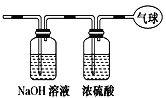
A.原混合气体所含氧原子总数为0.6 NA(用NA表示阿伏加德罗常数的值)
B.标况下气球中收集到的气体体积为4.48L
C.原混合气体的平均摩尔质量为32g/mol
D.原混合气体CO和CO2的体积比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是极易溶于水的气体,常温常压下,1体积水大约能溶解700体积的氨气。
(1)实验室可在浓氨水中加入固体NaOH快速制取氨气,请用化学平衡移动原理简述原因_______________________________________________________________。
(2)甲、乙两瓶氨水的浓度分别为1mol·L-1和0.1mol·L-1,则甲、乙两瓶氨水中c(OH-)之比________(填“>”、“<”或“=”)10。
(3)向10mL0.1 mol/L的氨水中逐滴加入20mL 0.1 mol/L的醋酸,溶液导电性的变化是__________________(填“增大”、“减小”或“不变”)。写出二者反应的离子方程式:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质制取的化学方程式中,不属于氧化还原反应的是( )
A.实验室制取氢气:Zn+H2SO4=ZnSO4+H2↑
B.实验室制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑
C.实验室制取氯气:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.工业上制取二氧化氯:2NaClO3+4HCl(浓)=2NaCl+2H2O+2ClO2↑+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研究发现纳米TiO2的混凝土可以适度消除汽车尾气中的氮氧化物,其原理如下。下列关于“消除”过程的叙述错误的是( )
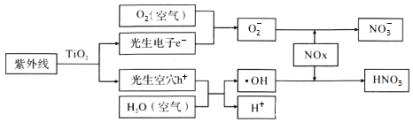
A.纳米TiO2作催化剂,NOx消除效率更高
B.NOx消除总反应为:4NOx+(5-2x)O2+2H2O![]() 4HNO3
4HNO3
C.1mol羟基(-OH)比1molO2少8NA个电子(NA为阿伏加德罗常数)
D.纳米TiO2属于胶体,能产生丁达尔现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com