
【题目】氨气是极易溶于水的气体,常温常压下,1体积水大约能溶解700体积的氨气。
(1)实验室可在浓氨水中加入固体NaOH快速制取氨气,请用化学平衡移动原理简述原因_______________________________________________________________。
(2)甲、乙两瓶氨水的浓度分别为1mol·L-1和0.1mol·L-1,则甲、乙两瓶氨水中c(OH-)之比________(填“>”、“<”或“=”)10。
(3)向10mL0.1 mol/L的氨水中逐滴加入20mL 0.1 mol/L的醋酸,溶液导电性的变化是__________________(填“增大”、“减小”或“不变”)。写出二者反应的离子方程式:_______________________________________________。
【答案】在浓氨水中存在NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动 < 先增强后减弱 NH3·H2O+CH3COOH== NH4++CH3COO-+H2O
NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动 < 先增强后减弱 NH3·H2O+CH3COOH== NH4++CH3COO-+H2O
【解析】
(1)、在浓氨水中存在NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动,所以实验室可在浓氨水中加入固体NaOH快速制取氨气,故答案为在浓氨水中存在NH3+H2O
NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动,所以实验室可在浓氨水中加入固体NaOH快速制取氨气,故答案为在浓氨水中存在NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动;
NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动;
(2)、甲瓶氨水的浓度是乙瓶氨水浓度的10倍,故甲瓶氨水的电离程度比乙瓶氨水的电离程度小,所以甲、乙两瓶氨水中c(OH-)之比小于10。故答案为:<;
(3)、氨水为弱电解质,开始导电性不强,滴入醋酸,反应生成醋酸铵,为强电解质,离子浓度增大,导电性增强,反应完全后,继续滴入醋酸,溶液体积变大,离子浓度减小,导电性又逐渐减弱,故答案为:先增强后减弱, NH3·H2O+CH3COOH== NH4++CH3COO-+H2O。


科目:高中化学 来源: 题型:
【题目】乙烯和乙烷的混合气体共amol,与bmol氧气共存于一密闭容器中,点燃后乙烯和乙烷充分燃烧,得到一氧化碳和二氧化碳的混合气体和45g水。
(1)一氧化碳和二氧化碳的混合气体总物质的量是_____,生成水的物质的量是____。
(2)当a=1时,乙烯和乙烷的物质的量之比是________。
(3)当a=1,且反应后一氧化碳和二氧化碳混合气体的物质的量是反应前氧气的2/3时,则b等于______,得到的一氧化碳和二氧化碳的物质的量之比是_____。
(4)a的取值范围是________,b的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探讨浓度对化学平衡的影响,某同学对可逆反应 “2Fe3++2I-![]() 2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。
2Fe2++I2 △H<0”按下图所示步骤进行了一系列实验。

说明:0.005 mol·L-1的Fe2(SO4)3溶液颜色接近于无色。
(1)实验中要待实验Ⅰ溶液颜色不再改变时,才能进行实验Ⅱ,目的是 。
(2)实验Ⅱ中,ⅰ的现象是 ,该实验证明 。
(3)实验Ⅱ中,ⅲ的化学平衡向 移动(填“正反应方向”或“逆反应方向”);ⅲ的现象是溶液变浅,该现象 (填“能”或“不能”)说明化学平衡发生移动。如果前一空填“能”,则下一空不填;如果前一空填“不能”,则ⅲ的目的是 。
(4)实验Ⅱ中,ⅱ的现象是 ,即能证明增大生成物浓度化学平衡发生了逆向移动。
(5)除了上图中的方法外,若要使该可逆反应的化学平衡逆向移动,还可以采用的方法有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 的资源化利用能有效减少 CO2 排放,充分利用碳资源。
⑴在海洋碳循环中,通过如图所示的途径固碳。
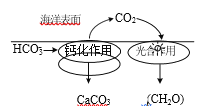
①写出钙化作用的离子方程式_____。
②同位素示踪法证实光合作用释放出的O2 只来自于H2O。用18O标记物质的光合作用的化学方程式如下,将其补充完整:
______________+________________![]()
⑵电解法转化 CO2 可实现 CO2 资源化利用。电解 CO2 制 HCOOK 的原理示意图如下。
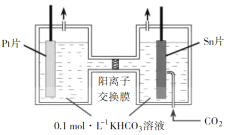
①阴极的电极反应式为_____。
②电解一段时间后,阳极区KHCO3 浓度下降,原因是______________________________________。
⑶CO2 催化加氢合成二甲醚是一种 CO2 转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g) + H2(g) === CO(g) + H2O(g) ΔH = +41.2 kJ·mol1
反应Ⅱ:2CO2(g) + 6H2(g) === CH3OCH3(g) + 3H2O(g) ΔH = 122.5 kJ·mol1
在恒压、CO2 和H2 的起始量一定的条件下,CO2 平衡转化率和平衡时 CH3OCH3 的选择性随温度的变化如图。
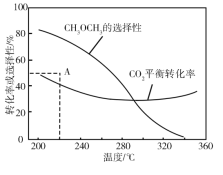
CH3OCH3 的选择性 =2CH3OCH3的物质的量反应的CO2的物质的量×100%
①温度高于300 ℃时,CO2 平衡转化率随温度升高而上升的原因是____________。
②220℃时,在催化剂作用下 CO2 与H2 反应一段时间后,测得 CH3OCH3 的选择性为48%(图中 A 点)。反应时间和温度不变,提高 CH3OCH3 选择性的措施有_________________。
A.增大压强 B. 使用对反应Ⅱ催化活性更高的催化剂 C. 及时移走产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃下,部分弱酸的电离常数如表。下列有关说法正确的是
弱酸 | HCOOH | HClO | H2S |
电离平衡 常数(Ka) | Ka=1.0×10-4 | Ka=2.0×10-8 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
A.相同浓度的HCOOH和HClO溶液的pH后者小
B.若HCOONa和HCOOH的混合溶液的pH=3,则![]() =10
=10
C.任何浓度NaHS溶液中总存在:c(Na+)+c(H+)=c(OH-)+c(HS-)
D.向NaClO溶液中通入H2S发生的反应为2ClO-+H2S===S2-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)广泛用于化工生产,常温下能与水反应,易溶于异丙胺(沸点为33 ℃)。工业上可用硼镁矿(主要成分为Mg2B2O5·H2O,含少量杂质Fe3O4)制取NaBH4,其工艺流程如下:
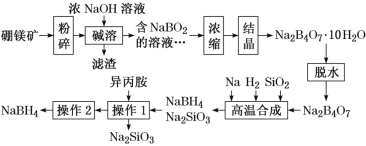
回答下列问题:
(1)NaBH4中氢元素的化合价为_______。
(2)碱溶时Mg2B2O5发生反应的化学方程式是________。
(3)滤渣的主要成分是_____。
(4)高温合成中,加料之前需将反应器加热至100 ℃以上,并通入氩气。通入氩气的目的是_____。
(5)操作2的名称为______,流程中可循环利用的物质是_____。
(6)在碱性条件下,用惰性电极电解NaBO2溶液也可制得NaBH4,装置如图所示,电解总反应的离子方程式为_______。

(7)NaBH4常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,1 g NaBH4的还原能力相当于_____g H2的还原能力(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
2H2(g)+O2(g)═2H2O(g) △H=484 kJ/mol
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
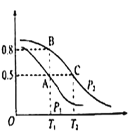
①A、B两点对应的压强大小关系是PA________PB(填“>”,“<”,“=”)
②A、B、C三点的平衡常数KA、KB、KC的大小关系是 ___________
③下列叙述能说明上述反应能达到化学平衡状态的是___(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(3)在P1压强、T1℃时,该反应的平衡常数K=_________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大”、“不变”或“减小”)
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正 ________ v逆(填>、< 或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)( )
A.所得溶液中c(Cu2+)=0.225mol/L B.所得溶液中c(Cu2+)=0.03mol/L
C.所得气体在标准状况下的体积为0.448L D.反应中转移0.06mol的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉和油脂为原料,制备生活中的某些物质。
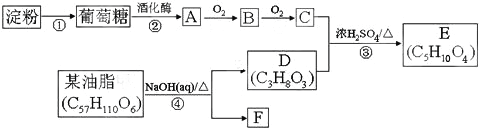
请回答:
(1)D中含有官能团的名称是____。
(2)反应④的有机反应类型是____。
(3)写出E可能的结构简式____。
(4)下列说法不正确的是____。
A.1molD最多可以和3mol金属Na反应,生成标准状况下336L氢气
B.葡萄糖、B以及淀粉这三者均能发生银镜反应
C.反应①和反应②的反应类型相同
D.A和D有相同的官能团,两者属于同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com