
A.H+、I-、NO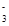 、SiO32- 、SiO32- | B.NH4+、OH-、Cl-、HCO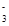 |
C.K+、SO42-、Cu2+、NO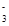 | D.Al3+、Mg2+、SO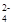 、CO 、CO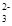 |
科目:高中化学 来源:不详 题型:单选题
| A.OH―、CO32―、SO42― | B.S2―、Cl―、SO42― |
| C.CO32―、NO3―、S2― | D.Cl―、SO42―、NO3― |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe2+、Fe3+、NH4+、NO3- | B.S2-、K+、I-、SO32- |
| C.Na+、I-、CO32-、NO3- | D.Al3+、HCO3-、OH-、Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+ |
| B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+ |
| C.c (Clˉ) 为 4.00 mol·L-1,c (Al3+) 为1.00 mol·L-1 |
| D.c (Mg2+) 为 1.00 mol·L-1,c(Na+ ) 为 0.50 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验内容 | 实验目的 |
| A | 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同条件下,溶解度Mg(OH)2>Fe(OH)3 |
| B | 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中NaOH含量 |
| C | 两种一元碱溶液X和Y(X的pH比Y大l),分别加水稀释l00倍后,pH相等 | 证明稀释前c(X)=10c(Y) |
| D | 测定等物质的量浓度的HF与HCl溶液的pH,后者较小 | 证明非金属性Cl>F |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com