
【题目】某烃结构式如下:![]() ,有关其结构说法正确的是
,有关其结构说法正确的是
A. 所有原子可能在同一平面上 B. 该分子不存在顺反异构
C. 所有碳原子可能在同一平面上 D. 1 mol 该烃最多可与4 mol氢气反应
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成(CH3)4NOH,其工作原理如下图所示(a、b为石墨电板,c、d、e为离子交换膜),下列说法正确的是( )

A. M为正极 B. c、e均为阳离子交换膜
C. b极电极反应式:2H2O-4e-=O2↑+4H+ D. 制备1mol(CH3)4NOH,a、b两极共产生0.5mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.01 mol·L-1两种弱酸溶液的pH如表,下列说法正确的是

A.相同pH的两种酸溶液中,CH3COOH溶液中水电离的c(H+)较大
B.物质的量浓度相同的CH3COONa与NaCN 溶液中,CH3COONa溶液pH较大
C.等体积pH相同的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH
D.HCN的电离平衡常数(Ka)与CN—的水解平衡常数(K)存在如下关系:KaK=Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是
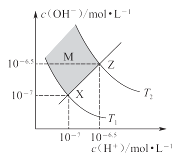
A. 两条曲线间任意点均有c(H+)·c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g) +2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是______(填序号)。
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)CO在不同温度下的平衡转化率与压强的关系如图1。
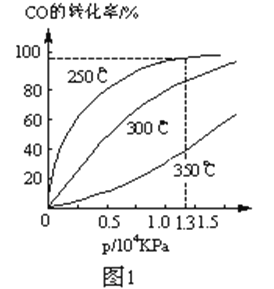
实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是______。
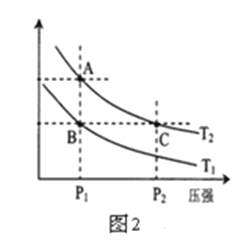
(3)右图2表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A______C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A______C,由状态B到状态A,可采用______的方法(填“升温”或“降温”)。
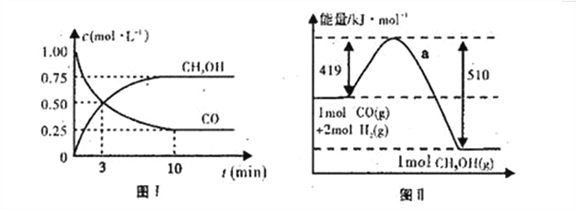
(4)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=______。
(5)写出该反应的热化学方程式______________________________
(6)当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(7)恒容条件下,下列措施中能使![]() 增大的有______
增大的有______
A.升高温度 B.充入He气 C.再充入1molCO和2molH2 D.使用催化剂
(8)在恒温条件下,保持CO浓度不变,扩大容器体积,则平衡______(填“逆向移动”、“正向移动”、“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J是中学化学常见的物质,它们之间的转化关系如下图所示 (部分反应条件、生成物已省略)。已知A是一种高熔点物质,D是一种红棕色固体。

请回答下列问题:
(1)电解A物质的阴极电极反应式为______________________。
(2)写出G→J反应的实验现象与化学方程式:_______________,__________。
(3)C与NaOH溶液反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氧化还原反应的本质是元素化合价的升降
B.氯化钠溶液在电流的作用下电离产生Na+、Cl-
C.发生氧化反应的物质也可能同时发生还原反应
D.氧化反应一定先于还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
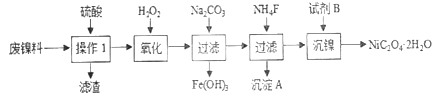
(1)操作1的名称为__________。
(2)保持其他条件相同,在不同温度下对废镍料进行“酸浸”,镍浸出率随时间变化如图。“酸浸”的适宜温度与时间分别为_______(填字母)。
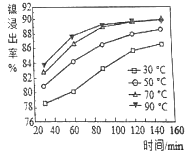
a.30℃、30min b.70℃、120min
c.90℃、150min d.90℃、120min
(3)沉淀A为CaF2和_________(填化学式)。
(4)试剂B的化学式为_________________。
(5)NiC2O4·2H2O样品经某稀酸酸化处理后,用稀KMnO4标准溶液滴定[在本实验条件下,Ni(Ⅱ)不能被氧化,其他物质不参与反应],通过测定草酸的量可测定NiC2O4·2H2O样品的纯度,滴定反应为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O。实验中称取0.183g样品,滴定时消耗了0.0400mol.L-1的KMnO4溶液8.00mL,则该样品中NiC2O4·2H2O的质量分数为_________。
(6)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体![]() 现象
现象![]() 现象
现象![]()
![]() 现象
现象![]() 现象
现象
①试剂1的名称为____________。
②证明混合气体有CO的现象是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向等物质的量浓度的NaC1、MgCl2、AlC13三种溶液中,加入足量的AgNO3溶液,产生的沉淀的质量比为3:2:1,则NaC1、MgCl2、AlC13三种溶液体积比为( )
A.9:3:1B.6:3:2C.3:2:1D.1:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com