
【题目】A~J是中学化学常见的物质,它们之间的转化关系如下图所示 (部分反应条件、生成物已省略)。已知A是一种高熔点物质,D是一种红棕色固体。

请回答下列问题:
(1)电解A物质的阴极电极反应式为______________________。
(2)写出G→J反应的实验现象与化学方程式:_______________,__________。
(3)C与NaOH溶液反应的离子方程式为________________________________。
【答案】A13++3e-=Al白色沉淀迅速变为灰绿色,最终变为红褐色4Fe(OH)2+O2+2H2O=4Fe(OH)32Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】
D是一种红棕色固体,为Fe2O3,C、D的反应为铝热反应,C为铝,A是一种高熔点物质,即可得A为Al2O3,B为O2,又可推得E为Fe,F为FeCl2,G为Fe(OH)2,和氧气反应,得J为Fe(OH)3,加热分解得D为Fe2O3。Al2O3和NaOH反应的H为NaAlO2,Al2O3和稀盐酸反应得I为AlCl3。
(1)电解熔融氧化铝得到铝和氧气,阴极上铝离子放电发生还原反应生成单质铝,电极反应式为:A13++3e-=Al;(2)G→J的反应为Fe(OH)2在空气中放置转化为Fe(OH)3的过程,实验现象为白色沉淀迅速变为灰绿色,最终变为红褐色,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;(3)C与NaOH溶液反应为铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】海水是自然赐给人类的宝藏,海水的综合利用是全世界研究的重点。完成下列问题:
(1)粗盐中除了含有泥沙之外还含有Ca2+、Mg2+、SO42-等杂质,粗盐获得精盐一般步骤如下:

加入的试剂①、②分别是:_________、_________。
(2)某学生在实验室中模拟海水提取溴的步骤为:
取25 L除去悬浮杂质后的海水,浓缩至2L,向其中通入足量氯气。
① 氧化步骤中生成Br2的离子方程式为_______________________________。
② 将吹出的Br2(g)用纯碱溶液全部吸收,发生反应:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑ ,产生的CO2通入足量澄清石灰水中,得到1g白色沉淀。计算海水中溴的浓度为_______g/L。
③实验室中若用CCl4提取少量的溴:向溴水中加入CCl4振荡、静置……得溴的四氯化碳溶液,该分离提纯溴的方法叫________;用到的主要仪器为_____________。
(3)实验证明金属制品在海水中更容易生锈,铜锈的化学式为: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2A(g)+B(g)![]() 3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
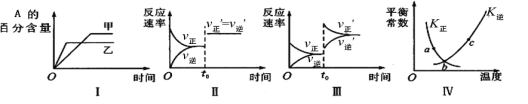
A.图I表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻缩小容器体积对反应速率的影响
C.图Ⅲ表示t0时刻增大B浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() Z(g)+W(s);△H>0下列叙述正确的是( )
Z(g)+W(s);△H>0下列叙述正确的是( )
A. 加入少量W,逆反应速率增大 B. 当容器中气体密度不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃结构式如下:![]() ,有关其结构说法正确的是
,有关其结构说法正确的是
A. 所有原子可能在同一平面上 B. 该分子不存在顺反异构
C. 所有碳原子可能在同一平面上 D. 1 mol 该烃最多可与4 mol氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示装置的实验,能达到实验目的的是( )

A. 图 1 配制稀硫酸
B. 图 2 食盐水制得食盐晶体
C. 图 3 比较苏打和小苏打的热稳定性
D. 图 4 铜与浓硫酸反应产生 SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
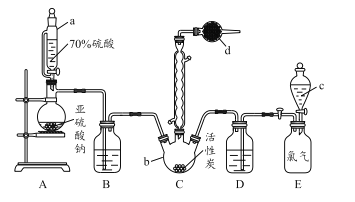
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:
已知:
①SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3 kJ/mol
SO2Cl2(l) △H=-97.3 kJ/mol
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是_____________________。
(2)仪器d中盛放的试剂为______。
A.无水硫酸铜 B.无水氯化钙 C.碱石灰 D.五氧化二磷
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为 ___________________。
(4) 装置E为储气装置,用于提供氯气,则分液漏斗c中盛放的试剂为_________。当装置E中排出氯气0.224 L(已折算成标准状况)时,最终得到1.08 g纯净的硫酰氯,则硫酰氯的产率为_____。
(5)长期存放的硫酰氯会发黄,其原因可能为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某基态原子的外围电子排布式为4d15s2,则下列说法正确的是()
A. 该元素基态原子中共有3个电子
B. 该元素原子核外有5个电子层
C. 该元素原子最外层共有3个电子
D. 该元素原子M能层共有8个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由简单的烃可合成多种有机物

已知:
![]()
(1)A的结构简式为________________
(2)D所含的官能团名称为_______ ,B→C的反应类型_____________
(3)已知1molE在一定条件下和1mol H2反应成成F,写出E→F的化学方程式_____________________________________
(4)E的顺式结构简式为_____________________
(5)关于I的说法正确的是______________________
A.能与溴水发生加成反应 B.能发生酯化反应
C.核磁共振氢谱有3组吸收峰 D.能与NaHCO3溶液反应
(6)写出C与M反应的化学方程式_______________________________
(7)以CH3CHO为有机原料,选用必要的无机试剂合成CH3CHOHCHOHCH2OH,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com