
【题目】三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(以镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。根据下列工艺流程示意图回答问题。
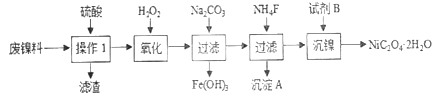
(1)操作1的名称为__________。
(2)保持其他条件相同,在不同温度下对废镍料进行“酸浸”,镍浸出率随时间变化如图。“酸浸”的适宜温度与时间分别为_______(填字母)。
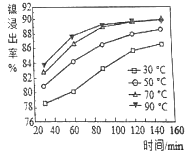
a.30℃、30min b.70℃、120min
c.90℃、150min d.90℃、120min
(3)沉淀A为CaF2和_________(填化学式)。
(4)试剂B的化学式为_________________。
(5)NiC2O4·2H2O样品经某稀酸酸化处理后,用稀KMnO4标准溶液滴定[在本实验条件下,Ni(Ⅱ)不能被氧化,其他物质不参与反应],通过测定草酸的量可测定NiC2O4·2H2O样品的纯度,滴定反应为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O。实验中称取0.183g样品,滴定时消耗了0.0400mol.L-1的KMnO4溶液8.00mL,则该样品中NiC2O4·2H2O的质量分数为_________。
(6)高温煅烧草酸镍制取三氧化二镍时会产生CO、CO2、水蒸气等混合气体。某同学设计如下实验流程进行检验。
混合气体![]() 现象
现象![]() 现象
现象![]()
![]() 现象
现象![]() 现象
现象
①试剂1的名称为____________。
②证明混合气体有CO的现象是_____________________________________________。
【答案】 过滤 b MgF2 H2C2O4或Na2C2O4(或可溶性的草酸盐等) 80.0% (无水)硫酸铜 黑色氧化铜(试剂2)变红色,澄清石灰水(试剂3)变浑浊(答案合理即可)
【解析】(1)镍废料中的镍、铁、钙、镁均可以和硫酸反应没生成硫酸盐,且硫酸钙属于微溶物,经过过滤除去不反应的杂质,和硫酸钙的不溶物,故操作1为过滤。
(2)根据图中的数据,在30℃、30 min时,镍的浸出率只有不到80%,此浸出率太低;在90℃时,120 min和150 min时的浸出率接近;而在120 min时,70℃和90℃时的浸出率相同。考虑经济效益还是选择低温合算,故选b。
由图知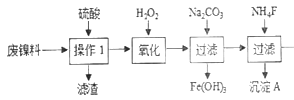 操作1除去了不溶的硫酸钙双氧水氧化Fe2+为Fe3+,加碳酸钠调节PH使Fe3+沉淀出来,加氟化铵,产生的沉淀为CaF2和MgF2。答案:MgF2。
操作1除去了不溶的硫酸钙双氧水氧化Fe2+为Fe3+,加碳酸钠调节PH使Fe3+沉淀出来,加氟化铵,产生的沉淀为CaF2和MgF2。答案:MgF2。
经过上述处理,除去铁、钙、镁等杂质,由图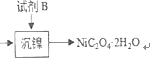 知试剂B为H2C2O4或Na2C2O4(或可溶性的草酸盐等)答案:H2C2O4或Na2C2O4(或可溶性的草酸盐等)
知试剂B为H2C2O4或Na2C2O4(或可溶性的草酸盐等)答案:H2C2O4或Na2C2O4(或可溶性的草酸盐等)
(5)根据反应方程式为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O 根据反应关系
5NiC2O4·2H2O---- 5H2C2O4-----2 MnO4-
X 0.0400mol.L-1![]() 8.00mL/1000
8.00mL/1000
X=8![]() 10-4mol
10-4mol
样品中NiC2O4·2H2O的质量分数为=8![]() 10-4mol
10-4mol![]() 183g/moL/0.183g=80.0%
183g/moL/0.183g=80.0%
(6) ① 高温煅烧NiC2O4的产物为三氧化二镍.CO、CO2、水蒸气,检验生成物时应先检验水,所以试剂1为无水硫酸铜.答案: 硫酸铜 。
②证明混合气体有CO的现象是
混合气体![]() 现象
现象![]() 现象
现象![]()
![]() 现象
现象![]() 现象
现象
根据上图知试剂1为硫酸铜,鉴别水,澄清的石灰水,鉴别CO2,试剂2为检验CO,可用黑色氧化铜粉末变红,再用澄清石灰水(试剂3)变浑浊即可。答案 :黑色氧化铜(试剂2)变红色。澄清石灰水(试剂3)变浑浊


科目:高中化学 来源: 题型:
【题目】二氧化硫是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2。2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O=CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是_______(用元素符号填写)。
(2)氧和硫属于同族元素,写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________________________________。
(3)NaOH的电子式为______________ 。
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式______________。
(5)钠一钙联合处理法的优点有________________。(任写一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃结构式如下:![]() ,有关其结构说法正确的是
,有关其结构说法正确的是
A. 所有原子可能在同一平面上 B. 该分子不存在顺反异构
C. 所有碳原子可能在同一平面上 D. 1 mol 该烃最多可与4 mol氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:
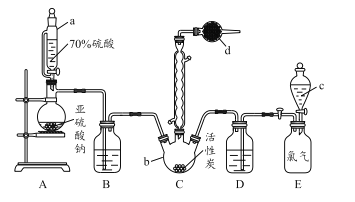
已知:
①SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3 kJ/mol
SO2Cl2(l) △H=-97.3 kJ/mol
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是_____________________。
(2)仪器d中盛放的试剂为______。
A.无水硫酸铜 B.无水氯化钙 C.碱石灰 D.五氧化二磷
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为 ___________________。
(4) 装置E为储气装置,用于提供氯气,则分液漏斗c中盛放的试剂为_________。当装置E中排出氯气0.224 L(已折算成标准状况)时,最终得到1.08 g纯净的硫酰氯,则硫酰氯的产率为_____。
(5)长期存放的硫酰氯会发黄,其原因可能为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2.L-1H2A溶液中滴另加0.2mol.L-1NaOH溶液。有关微粒的物质的量变化如图所示。根据图示判断正确的是
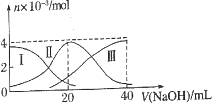
A. Ⅰ线表示A2-,Ⅱ线表示HA-
B. NaHA溶液中c(H+)>c(OH-)
C. 当V(NaOH)=21mL时:c(Na+)>c(A2-)>c(HA-)
D. 当V(NaOH)=40mL时:c(Na+)=2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某基态原子的外围电子排布式为4d15s2,则下列说法正确的是()
A. 该元素基态原子中共有3个电子
B. 该元素原子核外有5个电子层
C. 该元素原子最外层共有3个电子
D. 该元素原子M能层共有8个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中A、B、C、D、E为短周期主要族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外p电子数比s电子数少1 |
C元素基态原子p轨道有两个未成对电子 |
D原子的第一至第四电离能分别是: Ⅰ1=738kJ·mol-1;Ⅰ2=1451kJ·mol-1;Ⅰ3=7733kJ·mol-1;Ⅰ4=10540kJ·mol-1; |
E原子核外所有p轨道全满或半满 |
F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外最子排布为了![]() ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。
(2)B元素的电负性_____(填“大于”、“小于”或“等于”)C元素的电负性。
(3)C与D形成的化合物所含有的化学键类型为_____________。
(4)E基态原子中能量最高的电子,其电子云在空间有__________个方向。
(5)下列关于F原子的价层电子排布图正确的是___________。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(6)基态F3+离子核外电子排布式为_____________。过量单质F与B的最高价氧化物的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为____________。
(7)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类组合不正确的是( )
①混合物:空气、矿泉水、水银、盐酸
②酸性氧化物:CO、CO2、SO2、SO3
③酸:H2SO4、H2S、CH3COOH、NaHS04
④碱:生石灰、NH3·H2O、Cu(OH)2CO3
⑤盐:NaHCO3、纯碱、AlCl3
⑥电解质:HCl、CaCO3、NH3
A.①④B.①②④⑥C.①②③④⑥D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量之比为16∶7∶6的三种气体SO2、CO、NO,分子数之比为________;氧原子数之比为________;相同条件下的体积之比为________。
(2)标准状况下,1.7 g NH3的体积为________L,它与标准状况下________L H2S含有相同数目的氢原子。
(3)某气态氧化物的化学式为RO2,标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为__________,R的相对原子质量为________。
(4)在同温同压下,2 g CO2的体积为120 mL,而2 g A气体的体积为165 mL,则气体A的摩尔质量为________。标准状况下,11.2 L CO2和CO的质量是18 g,则其中含CO2的质量为________g,CO的体积为________。
(5)一储气瓶真空时质量为500 g。标准状况下,充满氧气后质量为508 g,装满某气体X后总质量为511 g。则该储气瓶的体积为________L,X的相对分子质量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com