
【题目】下列说法正确的是( )
A.氧化还原反应的本质是元素化合价的升降
B.氯化钠溶液在电流的作用下电离产生Na+、Cl-
C.发生氧化反应的物质也可能同时发生还原反应
D.氧化反应一定先于还原反应
科目:高中化学 来源: 题型:
【题目】反应方程式如下:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式______________________________。
(2)该反应的氧化剂为_____________,氧化产物是___________。
(3)用双线桥法表明该反应电子转移的方向和数目。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃结构式如下:![]() ,有关其结构说法正确的是
,有关其结构说法正确的是
A. 所有原子可能在同一平面上 B. 该分子不存在顺反异构
C. 所有碳原子可能在同一平面上 D. 1 mol 该烃最多可与4 mol氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年5月,我国在南海成功开采“可燃冰”(甲烷水合物),标志着在技术方面取得了突破性进展。甲烷是优质的清洁能源,综合开发利用能有效缓解大气污染问题。
已知:CH4(g)+2O2(g)=CO2(g) +2H2O(g) ΔH =- 802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1
H2O(g)=H2O(l) ΔH =- 44kJ·mol-1
则1mol CH4(g)不完全燃烧生成CO和H2O(l) 的热化学方程式为:________________。
(2)甲烷转化为CO和H2的反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。
①一定条件下,CH4的平衡转化率与温度、压强的关系如下图1所示。则P1________P2(填“<”、“>”或“=”) ;A、B、C 三点处对应的平衡常数(KA、KB、KC)由大到小的顺序为___________________。
②将CH4和H2O(g)按等物质的量混合,一定条件下反应达到平衡,CH4转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为________________。
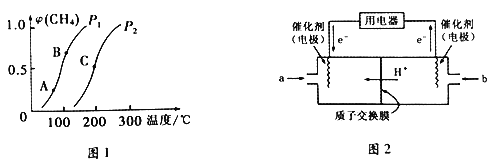
(3)甲烷燃料电池工作原理如上图2所示。a气体是______________,b气体通入电极的反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:
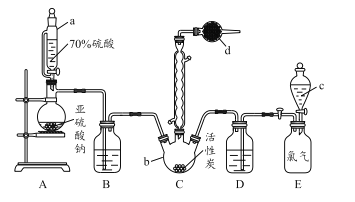
已知:
①SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3 kJ/mol
SO2Cl2(l) △H=-97.3 kJ/mol
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是_____________________。
(2)仪器d中盛放的试剂为______。
A.无水硫酸铜 B.无水氯化钙 C.碱石灰 D.五氧化二磷
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为 ___________________。
(4) 装置E为储气装置,用于提供氯气,则分液漏斗c中盛放的试剂为_________。当装置E中排出氯气0.224 L(已折算成标准状况)时,最终得到1.08 g纯净的硫酰氯,则硫酰氯的产率为_____。
(5)长期存放的硫酰氯会发黄,其原因可能为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2.L-1H2A溶液中滴另加0.2mol.L-1NaOH溶液。有关微粒的物质的量变化如图所示。根据图示判断正确的是
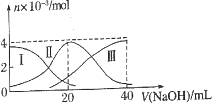
A. Ⅰ线表示A2-,Ⅱ线表示HA-
B. NaHA溶液中c(H+)>c(OH-)
C. 当V(NaOH)=21mL时:c(Na+)>c(A2-)>c(HA-)
D. 当V(NaOH)=40mL时:c(Na+)=2c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中A、B、C、D、E为短周期主要族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外p电子数比s电子数少1 |
C元素基态原子p轨道有两个未成对电子 |
D原子的第一至第四电离能分别是: Ⅰ1=738kJ·mol-1;Ⅰ2=1451kJ·mol-1;Ⅰ3=7733kJ·mol-1;Ⅰ4=10540kJ·mol-1; |
E原子核外所有p轨道全满或半满 |
F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外最子排布为了![]() ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。
(2)B元素的电负性_____(填“大于”、“小于”或“等于”)C元素的电负性。
(3)C与D形成的化合物所含有的化学键类型为_____________。
(4)E基态原子中能量最高的电子,其电子云在空间有__________个方向。
(5)下列关于F原子的价层电子排布图正确的是___________。
a.![]() b.
b.![]()
c.![]() d.
d.![]()
(6)基态F3+离子核外电子排布式为_____________。过量单质F与B的最高价氧化物的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为____________。
(7)元素铜与镍的第二电离能分别为:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 2.0 L 浓度均为 1.0 mol·L1 的 CuSO4、Fe2(SO4)3 和 H2SO4 的混合液中加入足量的铁粉,反应停止后,铁粉有剩余,此时溶液中 Fe2+ 的物质的量浓度是(溶液的体积变化忽略不计)
A. 1.5 mol·L1 B. 2.0 mol·L1 C. 3.0 mol·L1 D. 5.0 mol·L1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com