
【题目】M是一种重要材料的中间体,结构简式为:(CH3)2CHCOO ![]() CHO。合成M的一种途径如下:
CHO。合成M的一种途径如下:
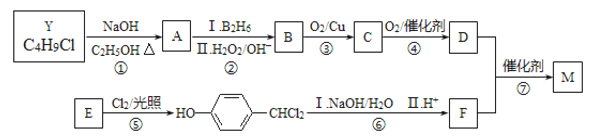
A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:①RCH=CH2 ![]() RCH2CH2OH
RCH2CH2OH
两个羟基连接在同一个碳原子上不稳定,易脱水;
请回答下列问题:
(1)若Y的核磁共振氢谱只有1种峰,则Y的结构简式为____________。
(2)A的名称是____________,由B生成C的反应类型为____________。
(3)M中的官能团有____________ (填官能团名称)。
(4)步骤⑥中反应I的化学方程式为___________________________。
(5)步骤⑦的化学反应方程式是_____________________________。
(6)D的同分异构体中,能在碱性条件下水解的有_______种(不包括立体异构),其中能发生银镜反应的同分异构体的结构简式为____________。
【答案】 (CH4)3CCl 2-甲基丙烯(或2-甲基-1-丙烯) 氧化反应 酯基、醛基 ![]() +3NaOH
+3NaOH ![]() +2NaCl+2H2O
+2NaCl+2H2O 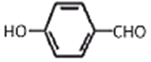 +(CH3)2CHCOOH
+(CH3)2CHCOOH ![]()
![]() +H2O 4种 HCOOCH2CH2CH3 HCOOCH(CH3)2
+H2O 4种 HCOOCH2CH2CH3 HCOOCH(CH3)2
【解析】Y的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,则Y为(CH3)3 CCl,在氢氧化钠醇溶液、加热条件下发生消去反应,生成A为CH2=C(CH3)2 ,A发生信息中的反应生成B为(CH3)2 CHCH2OH,B发生催化氧化生成C为(CH3)2 CHCHO,C再与氢氧化铜反应,酸化得到D为(CH3)2 CHCOOH,E的分子式为C7H8O,苯环上的一氯代物只有两种,应含有2个不同的侧链,且处于对位,则E为![]() ,与氯气在光照条件下发生取代反应,生成
,与氯气在光照条件下发生取代反应,生成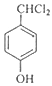 ,在氢氧化钠水溶液发生水解反应,酸化得到F,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故F为
,在氢氧化钠水溶液发生水解反应,酸化得到F,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故F为![]() ,F与D发生酯化反应生成M,其分子中含有醛基和酯基,故M为
,F与D发生酯化反应生成M,其分子中含有醛基和酯基,故M为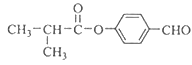
由上述分析(1)若Y的核磁共振氢谱只有1种峰,则Y的结构简式为 (CH4)3CCl;(2)A为CH2=C(CH3)2,A的名称是 2-甲基丙烯(或2-甲基-1-丙烯);(CH3)2 CHCH2OH,B发生催化氧化生成C为(CH3)2 CHCHO,由B生成C的反应类型为氧化反应 ;(3)M为 ,M中的官能团有酯基、醛基;(4)步骤⑥中
,M中的官能团有酯基、醛基;(4)步骤⑥中 ,在氢氧化钠水溶液发生水解反应,反应I
,在氢氧化钠水溶液发生水解反应,反应I ![]() +3NaOH
+3NaOH ![]() +2NaCl+2H2O ;(5)步骤⑦发生酯化反应,化学方程式为
+2NaCl+2H2O ;(5)步骤⑦发生酯化反应,化学方程式为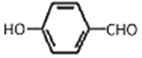 +(CH3)2CHCOOH
+(CH3)2CHCOOH ![]()
![]() +H2O ;(6)D的同分异构体中,能在碱性条件下水解的有HCOOCH2CH2CH3 、 HCOOCH(CH3)2、CH3COOCH2CH3、CH3CH2COOCH3共4种,其中含有醛基,能发生银镜反应的同分异构体的结构简式为HCOOCH2CH2CH3 、 HCOOCH(CH3)2。
+H2O ;(6)D的同分异构体中,能在碱性条件下水解的有HCOOCH2CH2CH3 、 HCOOCH(CH3)2、CH3COOCH2CH3、CH3CH2COOCH3共4种,其中含有醛基,能发生银镜反应的同分异构体的结构简式为HCOOCH2CH2CH3 、 HCOOCH(CH3)2。


科目:高中化学 来源: 题型:
【题目】《梦溪笔谈》中记载有:“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。烹胆矾则成铜;熬胆矾铁釜,久之亦化为铜。”下列对文中内容的解释正确的是( )
A. “苦泉”可使蛋白质变性 B. 胆矾的化学式为CuSO4
C. 胆矾受热不能分解 D. 胆矾与铁通过复分解反应可炼铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+CuSO4+2NH3H2O═Cu4O(PO)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的电子排布式:____________;与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有____________(填元素符号)。
(2)PO43-的空间构型是____________。
(3)P、S元素第一电离能大小关系为__________________,原因为__________________。
(4)NH3·H2O分子中NH3与H2O之间氢键表示为____________。(填序号)
A.N-H…O B.O-H…N C.H-N…H D.H-O…H
(5)氨基乙酸铜分子结构如图,碳原子的杂化方式为____________,基态碳原子核外电子有____________个空间运动状态。
![]()
(6)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol该配合物中含有的π键的数目为______________。
(7)铜晶体为面心立方最密堆积,配位数为_______________,铜的原子半径为127.8pm,NA表示阿伏伽德罗常数的值,列出晶体铜的密度计算式______________g/cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_______________。
(2)氨是制备氮肥、硝酸等的重要原料②③
①己知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g) ![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g) ![]() 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式________________。
②某电解法制氨的装置如右图所示,电解质只允许质子通过,试写出阴极的电极反应式__________。

(3)反应:2NO(g)+O2(g)![]() 2NO2(g)△H<0是制备硝酸过程中的一个反应。
2NO2(g)△H<0是制备硝酸过程中的一个反应。
①将NO和O2按物质的量之比为2:1置于恒温恒容密闭容器中进行上述反应,得到NO2体积分数与时间的关系如下图所示。保持其它条件不变,t1时再向容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2时再次达到平衡,请画出tl-t3时间范围内NO2体积分数随时间的变化曲线:____________。

②在研究此反应速率与温度的关系时发现,NO转化成NO2的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I 2NO(g) ![]() N2O2(g) △H<0
N2O2(g) △H<0
II N2O2(g)+O2(g) ![]() 2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO转化成NO2的速率减慢的可能原因________。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下0.lmol/L的CH3COONH4溶液中,(CH3COO-):c(NH3·H2O)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以铬铁矿(主要成分为亚铬酸亚铁FeCr2O4,还含有Al2O3、SiO2等杂质)为主要原料生产红矾钠(Na2Cr2O7),某实验小组模拟其流程如下图所示:
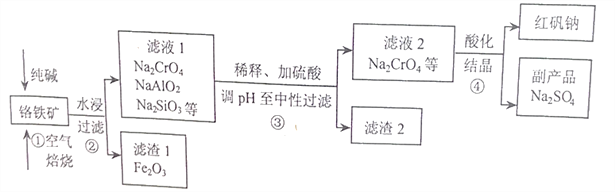
(1)FeCr2O4中Cr的化合价为____________,步骤①焙烧时所用的仪器名称为_________;步骤①中生成Na2CrO4的化学方程式为________________________。
(2)步骤①煅烧反应极慢,需要升温至纯碱呈熔融状态,反应速率才加快,其主要原因为________。
(3)步骤②过滤时所用到的玻璃仪器有________________;
(4)涉骤③用硫酸将溶液的pH调至中性,所得滤渣2的主要成分是__________、__________;
(5)步骤④向滤液2加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为___________。
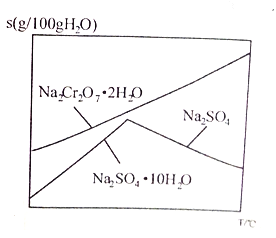
(6)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得副产品Na2SO4的实验操作方法为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2L的恒温恒容密闭容器中充入2mol SO2和1mol O2,发生反应2SO2(g)+O2(g) ![]() 2SO3(g) △H=-Q kJ·mol-l (Q>O),下列有关说法不正确的是
2SO3(g) △H=-Q kJ·mol-l (Q>O),下列有关说法不正确的是
A. 反应达到平衡时,放出热量为QkJ
B. 若容器的压强不再发生交化,则反应达到平衡
C. 反应过程中c(SO2)+ c(SO3)=1 mol·L-1恒成立
D. 平衡时,SO2、O2的转化率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com