
【题目】如表中物质分类完全正确的是 ( )
选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
A | 盐酸 | 水玻璃 | 硫酸 | 干冰 |
B | 小苏打 | 漂粉精 | 铁 | 氨气 |
C | 液氨 | 碱石灰 | 氢氧化钠 | 二氧化碳 |
D | 硝酸 | 食盐水 | 氯化铜 | 氯气 |
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种应用广泛的氧化剂和漂白剂。
(1)亚氯酸钠(NaClO2)中氯元素的化合价是____________;
(2)某同学通过查阅文献发现:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。该同学利用下图所示装置制取NaClO2晶体:

①装置B中盛装浓硫酸的仪器名称是______,装置C的作用是_________;
②已知装置B中的产物有ClO2气体,装置B中反应的化学方程式为___________________;
③装置D中发生反应的化学方程式为______________________________,反应后的溶液中除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有一种阴离子是_____,检验该离子的方法是_____________;
④反应结束后,先将装置D反应后的溶液在55℃条件下减压蒸发结晶,然后趁热过滤,再用38℃~60℃的温水洗涤,最后在低于60℃条件下干燥,得到NaClO2晶体。如果撤去装置D中的冷水浴,可能导致产品中混有的杂质是______________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存的无色离子组是( )
A. K+、Mg2+、Cl-、MnO4-B. Ba2+、NO3-、NH4+、Cl-
C. K+、Na+、SO32-、Cl-D. Na+、Cu2+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学的知识回答:
(1)A为0.1 mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为____________。
(2)B为0.1 mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:__________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入______溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为__________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL蒸馏水中;②100 mL 0.2 mol/L AgNO3溶液中;③100 mL 0.1 mol/L氯化铝溶液中;④100 mL 0.1 mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是___________ (填写序号);②中氯离子的浓度为_______mol/L。
Ag+(aq)+Cl-(aq),在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL蒸馏水中;②100 mL 0.2 mol/L AgNO3溶液中;③100 mL 0.1 mol/L氯化铝溶液中;④100 mL 0.1 mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是___________ (填写序号);②中氯离子的浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向淀粉中加少量稀H2SO4,并加热使之发生水解,为测定水解程度所需下列试剂是( )
①NaOH溶液 ②银氨溶液 ③新制Cu(OH)2 ④碘水 ⑤BaCl2溶液
A. ①⑤ B. ②④
C. ③④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组分子中,属于含极性键的非极性分子的是 _______________
BF3 、 H2S 、 CH3Cl 、 NH3 、 CS2、 C60、 C2H4 、 HCl
(2)按所示格式填写下表中的空格:
原子序数 | 原子的价电子排布式 | 周期 | 族 |
17 | ①______ | 第三 | ②______ |
③______ | 3d54s1 | ④______ | ⅥB |
(3)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是______,配离子 [Cu(NH3)4]2+中提供孤对电子的原子是_______________。
(4)镍的羰基配合物Ni(CO)4是获得高纯度纳米镍的原料,该配合物中镍原子的的价电子排布式为3d10,则其杂化轨道类型为____,Ni(CO)4是_____(填“极性”或“非极性”)分子。
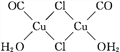
(5)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为____;氯化亚铜的盐酸溶液可定量吸收CO形成配合物Cu2(CO)2Cl2·2H2O(结构如图所示),该反应可用于测定空气中CO的含量,每个Cu2(CO)2Cl2·2H2O分子中含有____个配位键,____个σ键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A. 标况下,11.2L氟化氢中含有的分子数目为0.5NA
B. 室温下,21.0g乙烯和丁烯的混合气体中所含的碳原子数目是NA
C. 室温下,2L 0.05mol/L的NH4NO3溶液中所含有的氮原子数目是0.2NA
D. 22.4L Cl2与足量NaOH溶液反应时转移的电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com