
【题目】下列关于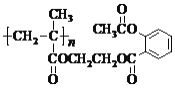 的说法,不正确的是
的说法,不正确的是
A.该物质可由n个单体分子通过缩聚反应生成
B.0.1 mol该物质完全燃烧,生成33.6 n L(标准状况)的CO2
C.该物质在酸性条件下水解产物之一可作汽车发动机的抗冻剂
D.1 mol该物质与足量NaOH溶液反应,最多可消耗4n mol NaOH
科目:高中化学 来源: 题型:
【题目】氟利昂是饱和碳氢化台物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下(以F-12 (二氯二氟甲烷)为例):
CF2Cl2![]() CF2Cl+Cl Cl+O3→ClO+O2
CF2Cl+Cl Cl+O3→ClO+O2
ClO+ClO→ClOOCl(过氧化氯) ClOOCl![]() 2Cl+O2
2Cl+O2
下列说法中不正确的是
A. 紫外线可以增大CF2Cl2的分解速率 B. ClO +ClO![]() ClOOC1的反应中有非极性键的形成
ClOOC1的反应中有非极性键的形成
C. CF2Cl2是臭氧破坏反应的催化剂 D. 臭氧屡破坏的关键因素有:氟利昂,太阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用。回答下列问题:
(1)Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为___,所含非金属元素的电负性由大到小的顺序为___。碳原子为____杂化,NO3-的空间构型为____。
(2)目前发现的铝原子簇Al13的性质与卤素相似,则原子簇Al13属于____晶体。Na[Al(OH)4]存在的化学键有 ___(填字母)。
A 离子键 B 极性键 C 非极性键 D 配位键 E 氢键 F 金属键
(3)已知:

反应后,当σ键增加了1 mol时,π键___(填“增加”或“减少”)了____个。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π34,则![]() (咪唑)中的“离域兀键”可表示为_______
(咪唑)中的“离域兀键”可表示为_______
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子之间的距离为_____ pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
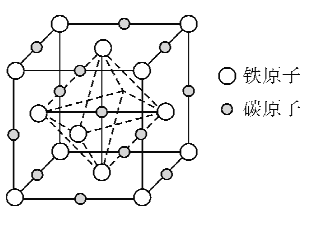
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.氯化钴溶液中存在平衡,![]() 粉红色
粉红色![]() 蓝色
蓝色![]() ,将氯化钴溶液置于冰水浴,溶液变成粉红色,则可知:
,将氯化钴溶液置于冰水浴,溶液变成粉红色,则可知:![]()
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.为了减小中和滴定的误差,锥形瓶必需洗净并烘干后才能使用
D.物质的分离提纯方法之一为“筛分”:如胶体![]() 半透膜法分离提纯;悬浊液
半透膜法分离提纯;悬浊液![]() 过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子”
过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子”
查看答案和解析>>
科目:高中化学 来源: 题型:
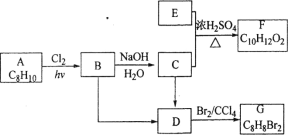
【题目】A~G都是有机化合物,它们的转化关系如图,请回答下列问题:
已知:RX+NaOH ![]() ROH+NaX
ROH+NaX
RCH2CH2X+NaOH ![]() RCH=CH2+NaX+H2O
RCH=CH2+NaX+H2O
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6 g H2O;E的蒸气与氢气的相对密度为30,则E的分子式为___________。
(2)A为一取代芳烃,B中含有一个甲基。由B生成C的化学方程式为________________。
(3)由B生成D、由C生成D的反应条件分别是_________、__________。
(4)由A生成B、由D生成G的反应类型分别是__________、__________。
(5)F存在于栀子香油中,其结构简式为___________。
(6)在G的同分异构体中,苯环上一硝化的产物只有一种的共有 _____个,其中核磁共振氢谱有两组峰,且峰面积比为l:1的是______________(填结构简式)。
(7) 已知烯烃能发生如下的反应:
![]() RCHO+R’CHO
RCHO+R’CHO
请写出下列反应产物的结构简式:
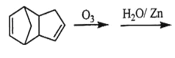 ________________________
________________________
(8) A是二聚环戊二烯(C10H12)的同分异构体,能使溴的四氯化碳溶液褪色,A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸[提示:苯环的烷基(—CH3,—CH2R,—CHR2)或烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):___________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
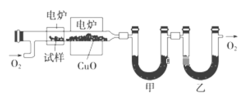
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收.2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3 (如图Ⅰ)
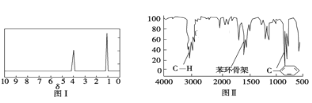
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为_________________。
(2)X的分子式为_____________;X的结构简式为___________ ;
II.某气态烷烃和气态单烯烃组成的混合气体,其密度是同条件下H2密度的13倍,把标准状况下2.24L,该混合体通入足量的溴水中,溴水增重1.4g。
(1)该混合烃的平均摩尔质量为__________;其中一定含有__________(写名称)。
(2)通过计算,确定另一种烃的分子式为_____________________ 。
(3)写出该混合烃中单烯烃所有可能的异构体(考虑顺反异构)__________________________________ 。
Ⅲ. 已知: ,如果要合成
,如果要合成![]() ,所用的原料可以是___________
,所用的原料可以是___________
A. 2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D. 2,3-二甲基-l,3-丁二烯和丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
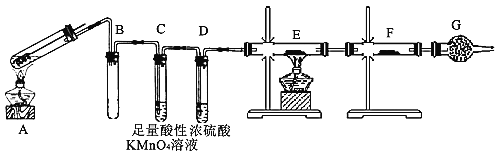
(1)B的作用是_____________,G的作用是____________;请写出C中发生的离子反应方程式_________。
(2)填写装置中可能使用的药品:E_________,F________。
(3)证明有H2生成的实验现象是__________。
(4)若判断出有H2生成,取少量A中反应后的溶液,加入KSCN溶液,溶液_____(填“是”或“否”)变红色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基础知识与技能考查
(1)Na2S2O3与稀硫酸反应(化学方程式):___;
(2)泡沫灭火器是硫酸铝和碳酸氢钠溶液反应,写出相关离子方程式:___;
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是___。(填写化学式,只填一种即可)
(4)碳酸氢钠溶液中:比较c(H2CO3)___c(CO32-)(答>,<,=)
(5)常温下,将0.1mol/L盐酸和0.1mol/L的NaOH按体积比11:9混合后,溶液的pH为___;
(6)写出碳酸钠溶液的物料守恒___;在2mol/L的氨水中,加入等体积1mol/L的盐酸,写出质子守恒(水的电离守恒):___;
(7)如图是甲烷燃料电池原理示意图,回答下列问题:电池的负极是___(填“a”或“b”)极,该极的电极反应式是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)密度为1.10 g/mL、质量分数为20%的盐酸的物质的量浓度为__________ mol/L
(2)取此盐酸50 mL和足量的镁反应后,求:
①放出的H2在标准状况下的体积_______________。
②将生成的H2缓慢通过过量的灼热CuO,求理论上被还原出的铜的质量__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com