
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用。回答下列问题:
(1)Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为___,所含非金属元素的电负性由大到小的顺序为___。碳原子为____杂化,NO3-的空间构型为____。
(2)目前发现的铝原子簇Al13的性质与卤素相似,则原子簇Al13属于____晶体。Na[Al(OH)4]存在的化学键有 ___(填字母)。
A 离子键 B 极性键 C 非极性键 D 配位键 E 氢键 F 金属键
(3)已知:

反应后,当σ键增加了1 mol时,π键___(填“增加”或“减少”)了____个。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π34,则![]() (咪唑)中的“离域兀键”可表示为_______
(咪唑)中的“离域兀键”可表示为_______
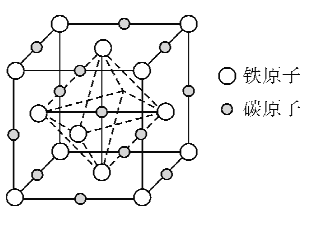
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子之间的距离为_____ pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
【答案】[Ar]3d5或1s22s23p63s23p63d5 O>N>C>H sp2杂化 平面三角形 分子 ABD 减少 NA(或6.02![]() 10-23)
10-23) ![]()
![]()
【解析】
(1)Fe为26号元素,基态Fe的电子排布式为1s22s22p63s23p63d64s2,失去3个电子生成Fe3+,则Fe3+的核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5;Fe(H2NCONH2)6](NO3)3中所含非金属元素为H、C、N、O,通常元素的非金属性越强,电负性越大,则所含非金属元素C、N、O、H中O的非金属性最强,H最弱,四者的电负性由大到小的顺序是O、N、C、H;Fe(H2NCONH2)6](NO3)3中尿素分子的结构简式为![]() ,C原子形成3个σ键,无孤对电子,所以是sp2杂化;NO3-中N的价层电子对数是3,且不存在孤对电子,所以NO3-的空间构型为平面三角形。答案:[Ar]3d5或1s22s22p63s23p63d65;O>N>C>H、sp2、平面三角形。
,C原子形成3个σ键,无孤对电子,所以是sp2杂化;NO3-中N的价层电子对数是3,且不存在孤对电子,所以NO3-的空间构型为平面三角形。答案:[Ar]3d5或1s22s22p63s23p63d65;O>N>C>H、sp2、平面三角形。
(2)卤素单质属于分子晶体,铝原子簇A113的性质与卤素相似,则原子簇A113也属于分子晶体。Na[Al(OH)4]属于离化合物,存在着离子键,铝是缺电子结构,能接受氢氧根离子给与的孤对电子形成配位键,氧氢之间可以形成极性键。所以Na[Al(OH)4]属于离化合物中含有离子键、极性键、配位键。答案:分子,ABD。
(3)每生成1mol氯吡苯脲,需要1mol2-氯-4-氨基吡啶、1mol异氰酸苯酯,反应过程中每个2-氯-4-氨基吡啶分子断裂一个σ键、每个异氰酸苯酯分子断裂一个π键,所以当σ键增加了1 mol时,π键减少了NA(或6.02![]() 10-23)个。答案:减少;NA(或6.02
10-23)个。答案:减少;NA(或6.02![]() 10-23)。
10-23)。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。因为![]() (咪唑)中的有5个原子参与形成π键,6个电子P轨道上的电子参与成键,所以咪唑的“离域兀键”可表示为
(咪唑)中的有5个原子参与形成π键,6个电子P轨道上的电子参与成键,所以咪唑的“离域兀键”可表示为![]() ;答案:
;答案:![]() 。
。
(5)晶胞结构分析可知一个晶胞中含铁原子8×1/8+6×1/2=4,碳原子12×1/4+1=4,化学式中铁原子和碳原子比为1:1,化学式为FeC;晶胞中最近的两个碳原子的距离设为x,立方体棱边的一半为a,则2a2=x2,a=![]() ,密度d=m/V=
,密度d=m/V=![]() ,解得x=
,解得x=![]() cm=
cm=![]() pm。答案:
pm。答案:![]() 。
。


科目:高中化学 来源: 题型:
【题目】在其他条件不变时,只改变某一条件,化学反应aA(g)+B(g)![]() cC(g)的平衡的变化图象如下(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是
cC(g)的平衡的变化图象如下(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是

A. 在图象反应Ⅰ中,说明正反应为吸热反应
B. 在图象反应Ⅰ中,若p1>p2,则此反应的ΔS>0
C. 在图象反应Ⅱ中,说明该正反应为吸热反应
D. 在图象反应Ⅲ中,若T1>T2,则该反应能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屈昔多巴( )可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等。以下是屈昔多巴的一种合成路线(通常
)可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等。以下是屈昔多巴的一种合成路线(通常![]() 简写为BnCl,
简写为BnCl,![]() 简写为CbzCl ):
简写为CbzCl ):

回答下列问题:
(1)反应①的反应类型为_____________,其作用为_________________。
(2)屈昔多巴中所含的非含氧官能团名称为_______________,屈昔多巴分子中有___________个手性碳原子。
(3)反应②为加成反应,有机物X的名称为______________________。
(4)![]() 显________________性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式:_______________________。
显________________性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式:_______________________。
(5)![]() 的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_______种,其中核磁共振氢谱为四组峰的结构简式为______________(任写一种)。
的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_______种,其中核磁共振氢谱为四组峰的结构简式为______________(任写一种)。
(6)参照上述合成路线,以对羟基苯甲醛为原料(无机试剂任选),设计制备对羟基苯甲酸的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1923年,在汉阳兵工厂工作的我国化学家吴蕴初先生研制出了廉价生产味精的方案,并于1926年向英、美、法等化学工业发达国家申请专利。这也是历史上中国的化学产品第一次在国外申请专利。以下是利用该方法合成味精的流程![]() 部分产物及反应条件已省略
部分产物及反应条件已省略![]() :
:
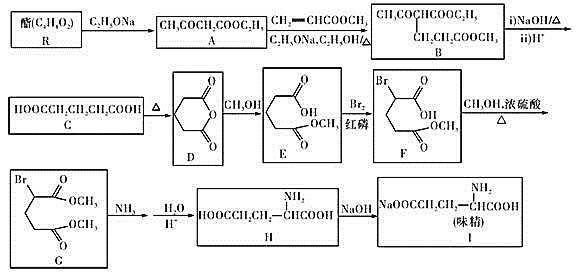
请回答下列问题:
![]() 下列有关蛋白质和氨基酸的说法不正确的是________
下列有关蛋白质和氨基酸的说法不正确的是________![]() 填字母代号
填字母代号![]() 。
。
![]() 蛋白质都是高分子化合物
蛋白质都是高分子化合物
![]() 谷氨酸
谷氨酸![]() 自身不能发生反应
自身不能发生反应
![]() 氨基酸和蛋白质都能发生盐析
氨基酸和蛋白质都能发生盐析
![]() 天然蛋白质水解的最终产物都是
天然蛋白质水解的最终产物都是![]() 氨基酸
氨基酸
![]() 的系统命名是________;F中含氧官能团的名称是_______________。
的系统命名是________;F中含氧官能团的名称是_______________。
![]() 的反应类型是____________,R的结构简式为_______________。
的反应类型是____________,R的结构简式为_______________。
![]() 写出G和
写出G和![]() 反应的化学方程式:_________________。
反应的化学方程式:_________________。
![]() 是H的同分异构体,T中同时具备下列条件的结构有________种。其中在核磁共振氢谱上有4组峰且峰的面积比为
是H的同分异构体,T中同时具备下列条件的结构有________种。其中在核磁共振氢谱上有4组峰且峰的面积比为![]() 的可能结构简式为_______。
的可能结构简式为_______。
![]() 能发生水解反应
能发生水解反应
![]() 只有2种官能团,其中一种是
只有2种官能团,其中一种是![]()
![]() 发生银镜反应能生成
发生银镜反应能生成![]() 银
银
![]() 参照上述流程,以
参照上述流程,以![]() 和甲醇为原料
和甲醇为原料![]() 其他无机试剂任选
其他无机试剂任选![]() ,设计合成苯丙氨酸
,设计合成苯丙氨酸![]()
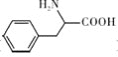
![]() 的流程:_____________________。
的流程:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法全部正确的一组是( )
①CH3—CH=CH2和CH2=CH2的最简式相同 ②CH≡CH和C6H6含碳量相同
③碳原子数不同的直链烷烃一定是同系物 ④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2 L的己烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
⑥邻二甲苯和液溴在光照下取代产物可能为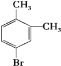
⑦鉴别己烯和苯:向己烯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色
A.①②③④⑦B.①②③④⑥C.①②④⑥D.①②④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将0.1 mol/L的NaOH溶液滴入盛有50 mLpH=2 的HA溶液的绝热容器中,加入NaOH溶液的体积V与溶液温度T的关系如图。下列说法正确的是( )
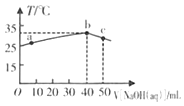
A.a点溶液中,c(A-)+c(HA)=0.08 mol/L
B.b点溶液中,c(A-)<c(Na+)
C.a→b的过程中,发生了吸热反应
D.溶液中HA的电离平衡常数a点等于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生态溶液涉及农家肥料的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO![]() CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
(1)原混合气体中甲烷的物质的量是____________。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于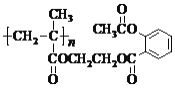 的说法,不正确的是
的说法,不正确的是
A.该物质可由n个单体分子通过缩聚反应生成
B.0.1 mol该物质完全燃烧,生成33.6 n L(标准状况)的CO2
C.该物质在酸性条件下水解产物之一可作汽车发动机的抗冻剂
D.1 mol该物质与足量NaOH溶液反应,最多可消耗4n mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
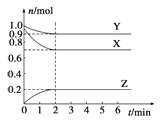
(1)该反应的化学方程式为_______________。
(2)反应开始至2min,气体Z的反应速率为_____________。
(3)若X、Y、Z均为气体,反应达平衡时:①压强是开始时的_______倍;②若此时将容器的体积缩小为原来的0.5倍,达平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为_________反应(填“放热”或“吸热”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com