
【题目】(1)密度为1.10 g/mL、质量分数为20%的盐酸的物质的量浓度为__________ mol/L
(2)取此盐酸50 mL和足量的镁反应后,求:
①放出的H2在标准状况下的体积_______________。
②将生成的H2缓慢通过过量的灼热CuO,求理论上被还原出的铜的质量__________
【答案】6.03 3.38 9.64g
【解析】
(1)根据c=![]() 计算出该盐酸的物质的量浓度;
计算出该盐酸的物质的量浓度;
(2)①根据n=cV计算出溶液中含有氯化氢的物质的量,再根据氢原子守恒计算出生成氢气的物质的量,然后根据V=nVm计算出标况下氢气的体积;
②根据H2+CuO=Cu+H2O写出氢气与氧化铜、铜的关系式,然后计算出还原产物的质量。
(1)该盐酸的物质的量浓度为:c=![]() mol/L=6.03mol/L;
mol/L=6.03mol/L;
(2)①50mL 6.03mol/L的该盐酸溶液中含有溶质氯化氢的物质的量为:n(HCl)=6.03mol/L×0.05L=0.3015mol,根据H原子质量守恒定律可知,生成氢气的物质的量为:n(H2)=![]() ×0.3015mol=0.15075mol,标况下0.15075mol氢气的体积为:22.4L/mol×0.15075mol≈3.38L;
×0.3015mol=0.15075mol,标况下0.15075mol氢气的体积为:22.4L/mol×0.15075mol≈3.38L;
②根据H2+CuO=Cu+H2O可得,氢气与氧化铜反应的关系式为:H2~CuO~Cu,则0.15075mol氢气完全反应还原的Cu的物质的量为0.15075mol,0.15075mol铜的质量为:64g/mol×0.15075mol≈9.64g。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于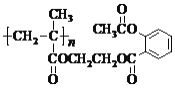 的说法,不正确的是
的说法,不正确的是
A.该物质可由n个单体分子通过缩聚反应生成
B.0.1 mol该物质完全燃烧,生成33.6 n L(标准状况)的CO2
C.该物质在酸性条件下水解产物之一可作汽车发动机的抗冻剂
D.1 mol该物质与足量NaOH溶液反应,最多可消耗4n mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
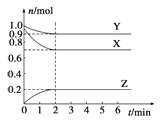
(1)该反应的化学方程式为_______________。
(2)反应开始至2min,气体Z的反应速率为_____________。
(3)若X、Y、Z均为气体,反应达平衡时:①压强是开始时的_______倍;②若此时将容器的体积缩小为原来的0.5倍,达平衡时,容器内温度将降低(容器不与外界进行热交换),则该反应的正反应为_________反应(填“放热”或“吸热”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2与O2发生反应的过程用模型图示如下(“﹣”表示化学键):下列说法不正确的是: ( )
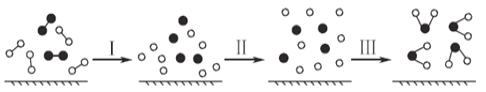
A.过程Ⅰ是吸热过程B.该反应的能量转化形式只能以热能的形式进行
C.过程Ⅲ一定是放热过程D.该反应过程所有旧化学键都断裂,且形成了新化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R元素的一种原子可表示为:![]() ,则下列说法中正确的是
,则下列说法中正确的是
A.R元素的相对原子质量的近似整数值在数值上等于A
B.R元素的近似相对原子质量为A
C.R元素的近似相对原子质量为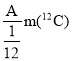 (其中m(
(其中m(![]() )表示一个碳-12原子的质量)
)表示一个碳-12原子的质量)
D.无法计算出R元素的近似相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S(常温下,氢硫酸的Ka1=5.7×10-8,Ka2=1.2×10-15)广泛存在于天然气、合成氨原料气、炼厂气等,生产中需脱硫处理。回答下列问题
(1)著名的 Vanviel反应为2nH2S+nCO2![]() (CH2O)n+nH2O+2nS↓,该反应能量转化形式是________。
(CH2O)n+nH2O+2nS↓,该反应能量转化形式是________。
(2)脱除天然气中H2S的工艺流程如下
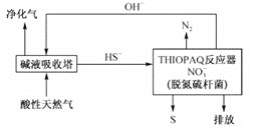
①常温下,“碱液吸收塔”中反应HS-+OH- ![]() S2-+H2O的平衡常数K=________。
S2-+H2O的平衡常数K=________。
②“ THIOPAO”反应器中,在脱氮硫杆菌的作用下,HS-氧化为S的离子方程式为________。
(3)铜(Ⅱ)沉淀及铜(Ⅱ)湿式氧化脱除硫化氢并可回收硫磺,主要步骤如下
(a)吸收H2S
(b)生成CuS沉淀
(c)CuCl2氧化CuS生成单质S和CuCl2-
(d)通O2再生
①常温下,沉淀反应之一:HS-+Cu2+![]() CuS+H+的平衡常数K= ________(已知常温下,KSP(CuS)=4×10-35)。
CuS+H+的平衡常数K= ________(已知常温下,KSP(CuS)=4×10-35)。
②CuCl2氧化CuS的离子方程式为 ________。
③通O2再生时的离子方程式为________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下表中实验操作或现象的解释不合理的是![]()
实验操作及现象 | 现象的解释 | |
A | 将一片铝箔置于酒精灯外焰上灼烧,铝箔熔化但不滴落 | 单质铝的熔点特别高 |
B | 用玻璃尖嘴导管导出氢气,点燃,观察到火焰呈黄色 | 普通玻璃中含有钠元素 |
C | 往水中加入 | 产生了碱性物质,且 |
D | 向过量的苯酚浓溶液中滴加少许饱和溴水,振荡,未观察到白色沉淀产生 | 三溴苯酚溶解在过量的苯酚中 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
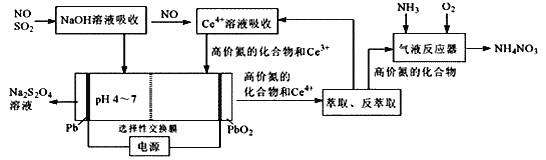
【题目】一种利用电化学方法同时脱除NO/SO2的工艺如图所示:
已知SO2水溶液中含硫微粒分布分数(Xi)与pH关系如图所示
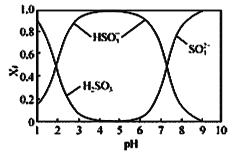
(1)NaOH溶液吸收SO2时,溶液的pH由9→6时,主要发生反应的离子方程式为________。
(2)含Ce4+的溶液吸收NO,若高价氮中的NO2、N2O3、NO2-、NO3-各1mol,则消耗0.5mol·L-1的含Ce4+溶液的体积为________L;其中NO转化NO3-的离子方程式为________。
(3)电解槽中,阴极电极反应式主要为________,阳极电极反应式为________。
(4)在“气液反应器”中高价氮中的N2O3化合为NH4NO3的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是 ( )
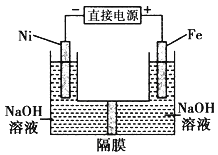
A.铁是阳极,电极反应为 Fe-6e一+4H2O=FeO42-+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜, 则电解结束后左侧溶液中含有FeO42-
D.电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com