
【题目】对下表中实验操作或现象的解释不合理的是![]()
实验操作及现象 | 现象的解释 | |
A | 将一片铝箔置于酒精灯外焰上灼烧,铝箔熔化但不滴落 | 单质铝的熔点特别高 |
B | 用玻璃尖嘴导管导出氢气,点燃,观察到火焰呈黄色 | 普通玻璃中含有钠元素 |
C | 往水中加入 | 产生了碱性物质,且 |
D | 向过量的苯酚浓溶液中滴加少许饱和溴水,振荡,未观察到白色沉淀产生 | 三溴苯酚溶解在过量的苯酚中 |
A.AB.BC.CD.D
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。为此,他们设计了如下装置验证所产生的气体。
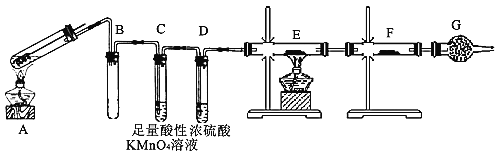
(1)B的作用是_____________,G的作用是____________;请写出C中发生的离子反应方程式_________。
(2)填写装置中可能使用的药品:E_________,F________。
(3)证明有H2生成的实验现象是__________。
(4)若判断出有H2生成,取少量A中反应后的溶液,加入KSCN溶液,溶液_____(填“是”或“否”)变红色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,它们的核电荷数依次增大。已知:A失去一个电子后就成为一个质子;B有两个电子层,其最外层的电子数是次外层电子数的2倍;C的L层得2个电子后成为稳定结构;D是海水中含量第一位的金属元素;E的最外层电子比次外层电子少一个。请填写下列空格:
(1)A形成的单质的结构式为______; BC2的电子式_______________。
(2)D离子的结构示意图_________,D、E结合形成的化合物的电子式_____
(3)B、C、D三种元素可形成一种化合物,其化学式为_____,所含的化学键有____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)密度为1.10 g/mL、质量分数为20%的盐酸的物质的量浓度为__________ mol/L
(2)取此盐酸50 mL和足量的镁反应后,求:
①放出的H2在标准状况下的体积_______________。
②将生成的H2缓慢通过过量的灼热CuO,求理论上被还原出的铜的质量__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钛、钡(第2主族)等元素在能源、材料等领域应用广泛。回答下列问题:
⑴与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有________种。基态Ti2+的最外层电子排布式为________________。
⑵铝的逐级电离能数据为:I1=580 kJmol-1、I2=1820 kJmol-1、I3=2750 kJmol-1、I4=11600 kJmol-1。请分析数据规律,预测钡的逐级电离能的第一个数据“突跃”点出现在________之间(用I1、I2、I3等填空![]() 。
。
⑶已知第ⅡA族元素的碳酸盐MCO3热分解的主要过程是:M2+结合碳酸根离子中的氧离子。则CaCO3、BaCO3的分解温度较高的是________________(填化学式),理由是________________。
⑷催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如图1所示。
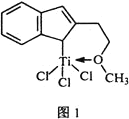
①M中,碳原子的杂化类型有________________。
②M中,不含________![]() 填标号
填标号![]() 。
。
A. π键 B. δ键 C. 配位键 D.氢键 E. 离子键
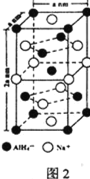
⑸氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图2所示,为长方体。写出与AlH4-空间构型相同的一种分子_______________(填化学式)。NaAlH4晶体中,与AlH4-紧邻且等距的Na+有________个;NaAlH4晶体的密度为________ gcm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
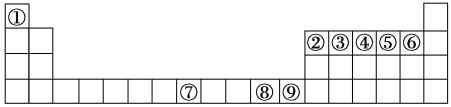
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的______________区。
(2)②、⑥两元素形成的化合物的空间构型为______________,其中心原子的杂化轨道类型为________。
(3)写出元素③与元素⑤形成的稳定化合物的结构式_______________。
(4)⑧的二价阳离子与过量的④的氢化物的水化物作用的离子方程式为:______。
(5)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为________。
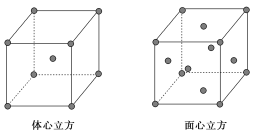
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据如图所示,回答下列问题:

(1)Y是形成酸雨的主要物质之一,它溶于水反应的化学方程式为_____;另一类硝酸型酸雨主要由人类活动产生的NOx造成的,写出NO2与水反应的化学方程式为______;酸雨的pH______(填范围)。
(2)Y能使品红溶液褪色,它与一种黄绿色气体等体积通入水中得到的溶液却几乎没有漂白性,反应的离子方程式为_______;Y也能使酸性高锰酸钾溶液褪色,写出该反应的离子方程式______,并用单线桥法标明电子转移的方向和数目,体现了Y的_____性。
(3)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为_____。
(4)现用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL,回答下列问题:
①所需浓硫酸的体积为______mL。
②将浓硫酸沿烧杯内壁缓缓注入盛水的烧杯中,不断搅拌的目的是_____,若搅拌过程中有液体溅出,会导致最终所配溶液浓度_____(填“偏大”、“偏小”或“无影响”,下同)。
③在转入容量瓶前,烧杯中的液体应先_____,否则会使浓度_____。
(5)已知S的氧化性较弱,则硫粉与铜加热反应的化学方程式为_____。
(6)欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,合理的是_____(填序号)。
A.Na2S+S B.Na2SO3+S C.Na2SO3+Na2SO4 D.SO2+Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,达到平衡后c(X(2)为0.4mol/L,c(Y(2)为0.8mol/L,生成的c(Z)为0.4mol/L,则该反应是
A.3X2+Y2![]() 2X3YB.X2+3Y2
2X3YB.X2+3Y2![]() 2XY3C.X2+2Y2
2XY3C.X2+2Y2![]() 2XY2D.2X2+Y2
2XY2D.2X2+Y2![]() 2X2Y
2X2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET(![]() ,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
A.PET塑料是一种可降解高分子材料
B.滴定终点时,溶液变为浅红色
C.合成PET的一种单体是乙醇的同系物
D.PET的平均聚合度![]() (忽略端基的摩尔质量)
(忽略端基的摩尔质量)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com