
【题目】反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2=2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。
c(H2)/mol·L-1 | c(Cl2)/mol·L-1 | v/mol·L-1·s-1 |
1.0 | 1.0 | 1.0 k |
2.0 | 1.0 | 2.0 k |
2.0 | 4.0 | 4.0 k |
由此可推得,m、n值正确的是( )
A.m=1,n=2B.m=1,n=![]()
C.m=![]() ,n=1D.m=
,n=1D.m=![]() ,n=
,n=![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学们分别设计了如图甲、乙所示的实验装置。请回答相关问题:

(1)定性甲所示装置可通过观察___,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___。
(2)定量如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为___,实验中需要测量的数据是___。
Ⅱ.以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验序号 | H2O2溶液浓度/% | H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集O2的体积/mL | 反应所需时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
(1)写出实验①中H2O2分解的化学方程式___。
(2)通过实验①和②对比可知,化学反应速率与____有关;从实验③和④对比可知,化学反应速率与温度的关系是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g) ![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是![]()
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、 B、 C、 D、 E、 F 为前四周期元素且原子序数依次增大,其中基态 A 原子的电子分布在 3 个能级,且每个能级所含的电子数相同; C 的原子核外最外层有 6 个运动状态不同的电子; D 是短周期元素中电负性最小的元素; E 的最高价氧化物的水化物酸性最强; 基态 F 原子核外最外层只有一个电子, 其余能层均充满电子。 G 元素与 D 元素同主族,且相差 3 个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是____________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为____________________________。
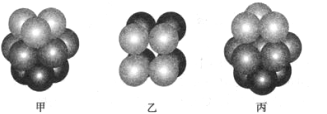
(3)F原子的外围电子排布式为_______________________, F 单质晶体中原子的堆积方式是下图中的_______(填写“甲”、 “乙”或“丙”) ,该晶体的空间利用率为_____________。(保留两位有效数字)
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下, D 单质的熔沸点比 G 单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如下图所示:
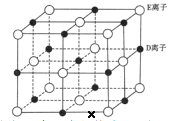
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是______________g·cm-3(列式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验制备Ca(NO2)2,实验装置如图所示(夹持装置已略去)。已知:2NO+CaO2==Ca(NO2)2;2NO2+CaO2==Ca(NO3)2。下列说法不正确的是
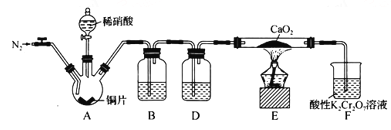
A. 通入N2是为了排尽装置中的空气
B. 装置B、D中的试剂可分别为水和浓硫酸
C. 将铜片换成木炭也可以制备纯净的亚硝酸钙
D. 借助装置A及氢氧化钠溶液和稀硫酸可以分离CO2和CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是

A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如表,下列说法正确的是( )
温度 | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A.ΔH>0
B.1000℃时,在固定体积的密闭容器中,某时刻测得上述体系中,CO、CO2的物质的量分别为0.5 mol、1.8 mol,此时反应向正反应方向进行
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以提高CO的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将SO2气体通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
C | AgCl悬浊液中滴入少量Na2S溶液 | 沉淀变黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com