
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。
Ⅰ.利用甲醇(CH3HO)制备甲醛
脱氢法:CH3OH(g) HCHO(g)+H2 (g) ΔH1=+92.09kJ·mol -1
氧化法:CH3OH(g)+1/2O2(g)HCHO(g)+H2O(g) ΔH2
(1)脱氢法制甲醛,有利于提高平衡产率的条件有________ (写出一条)。
(2)已知:2 H2(g) + O2(g)= 2H2O(g) ΔH3=-483.64kJ·mol -1,则ΔH2=________________。
(3)750K 下,在恒容密闭容器中,充入一定量的甲醇,发生脱氢法反应,若起始压强为P0,达到平衡时转化率为40.0% ,则反应的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(4)Na2CO3是脱氢法反应的催化剂,有研究指出,催化反应的部分机理如下:
历程i :CH3OH→·H+ ·CH2OH 历程ii :·CH2OH→·H+ HCHO
历程iii:.·CH2OH→3·H +CO 历程iv:·H+·H→H2
如图所示为在体积为1L的恒容容器中,投入1mol CH3OH,在碳酸钠催化剂作用下,经过10min反应,测得甲醇的转化率(X)与甲醇的选择性(S)与温度的关系(甲醛的选择性:转化的CH3OH中生成HCHO的百分比)。回答下列问题:
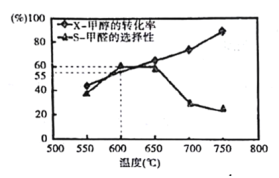
①600℃时,前10min内甲醛的平均速率为v(HCHO)=______
②从平衡角度分析550℃- 650℃甲醇生成甲醛的转化率随温度升高的原因为______;
③反应历程i的活化能______(填“>”“<” 或“=”)CH3OH(g)HCHO(g)+H2(g)活化能。
④650℃- 750℃反应历程ii的速率_______(填“>”“<” 或“=”)反应历程iii的速率。
Ⅱ.甲醛超标会危害人体健康,需对甲醛含量检测及处理。
某甲醛气体探测仪利用燃料电池工作原理,b电极反应方程式为________。

【答案】升高温度或降低压强 -149.73 kJ·mol -1 ![]() 0.033mol/(L·min) 甲醇脱氢为吸热反应,升高温度,有利于脱氢反应向正反应方向进行 < < HCHO-4e-+H2O=CO2+4H+
0.033mol/(L·min) 甲醇脱氢为吸热反应,升高温度,有利于脱氢反应向正反应方向进行 < < HCHO-4e-+H2O=CO2+4H+
【解析】
Ⅰ.(1)脱氢法制甲醛,CH3OH(g) HCHO(g)+H2 ΔH1=+92.09kJ·mol -1,由于该反应的正反应是吸热反应,所以可以升高温度,使平衡正向移动,从而提高甲醛的产率;又由于该反应的正反应是体积增大的反应,所以可以降低压强使平衡正向移动,也可以提高甲醛的产率。故答案为升高温度或降低压强。
(2)根据①CH3OH(g) HCHO(g)+H2 (g) ΔH1=+92.09kJ·mol -1和②2 H2(g) + O2(g)= 2H2O(g) ΔH3=-483.64kJ·mol -1,①+②÷2即可得到反应CH3OH(g)+1/2O2(g)HCHO(g)+H2O(g),ΔH2=+92.09kJ·mol -1+(-483.64kJ·mol -1)÷2=-149.73 kJ·mol -1。
(3)用三段式解答:起始压强为P0,达到平衡时转化率为40.0% ,则
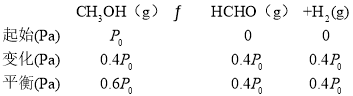
则反应的中衡常数Kp=![]() =
=![]() 。
。
(4)①600℃时,前10min内甲醇的物质的量变化为1mol×55%×60%=0.33mol,容器体积为1L,所以平均速率为v(CH3OH)=0.033mol/(L·min)。用不同物质表示的速率之比等于方程式的化学计量数之比,根据化学方程式,所以v(HCHO)=0.033mol/(L·min)。
②甲醛脱氢反应为吸热反应,在550℃- 650℃升高温度,有利于反应正向进行,所以甲醇生成甲醛的转化率随温度升高而增大。
③由盖斯定律可知,ⅰ+ⅱ+ⅳ得到目标方程式CH3OH(g) HCHO(g)+H2 (g),前两个历程化学键断裂吸收能量,历程ⅳ自由基结合放出能量,而总反应是吸热反应,因此反应历程i的活化能小于总反应的活化能。
④由图可知,在650℃- 750℃,随着温度升高,甲醇的转化率增大,但选择性却降低,说明甲醇更多的转化为CO,历程ⅲ的反应速率较大,因此反应历程ii的速率小于反应历程iii的速率。
Ⅱ.在燃料电池中,通入燃料的一极是负极,所以b为负极,甲醛在负极失去电子生成CO2,电解质溶液是酸性的,所以电极反应方程式为HCHO-4e-+H2O=CO2+4H+。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】近来有报道,碘代化合物E与化合物G在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:①RCN![]() RCOOH
RCOOH
②RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
回答下列问题:
(1)D的结构简式为________。
(2)下列说法正确的是__________。
A.物质A中最多有5个原子在同一平面内 B.D生成E的反应为取代反应
C.物质G和银氨溶液能发生反应 D.物质Y的分子式为C15H18O3
(3)B为单氯代烃,由B生成C的化学方程式为_________。
(4)写出同时符合下列条件的D的所有同分异构体的结构简式_______。
①具有完全相同的官能团,且不含“—O—C≡C—”;
②核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。
(5)以苯甲醇、乙醛为原料制备F,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:
(1)可以用来鉴别甲烷和乙烯的试剂是 。
A.水
B.稀硫酸
C.溴水
D.酸性高锰酸钾溶液
(2)在一定条件下,乙烯能与水反应生成有机物A,则A的结构简式是 。
(3)某同学在学习A的知识后,设计了如下实验。操作步骤为:
①在试管里加入2 mL A;
②把一端弯成螺旋状的铜丝放在酒精灯外焰中加热;
③立即将铜丝插入盛有A的试管里,反复操作几次;
④闻生成物的气味,观察铜丝表面的变化。
第④步操作中,铜丝表面的变化是 ;写出第③步操作中发生反应的化学方程式: 。
(4)A在一定条件下可以被氧化成乙酸,用化学方程式说明乙酸和碳酸的酸性强弱: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件和医药及化工等领域。
Ⅰ.(1)锑在元素周期表中的位置_____。
(2)锑(Ⅲ)的氧化物被称为锑白,可以由SbCl3水解制得,已知SbCl3水解的最终产物为锑白。为了得到较多、较纯的锑白,操作时将SbCl3徐徐加入大量水中,反应后期还要加入少量氨水。试用必要的化学用语和平衡移动原理解释这两项操作的作用_______。工业上,还可用火法制取锑白,是将辉锑矿(主要成分为Sb2S3)装入氧化炉的坩埚中,高温使其融化后通入空气,充分反应后,经冷却生成锑白。写出火法制取锑白的化学方程式______。
Ⅱ.以辉锑矿为原料制备金属锑,其中一种工艺流程如下:
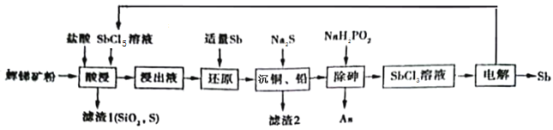
已知部分信息如下:
①辉锑矿(除Sb2S3外,还含有砷、铅、铜的化合物和SiO2等);
②浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
③常温下,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(3)“酸浸”过程中Sb2S3发生反应的化学方程式为_____。
(4)已知:浸出液中c(Cu2+)=0.0001mol/L,c( Pb2+)=0.1mol/L。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生沉淀的是_____(填化学式);当CuS、PbS共沉沉时,![]() =______(保留小数点后一位)。
=______(保留小数点后一位)。
(5)在“除砷”过程中,氧化产物为H3PO4。该反应氧化产物与还原产物的物质的量之比为__________。
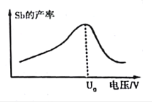
(6)在“电解”过程中,锑的产率与电压大小关系如图所示。当电压超过U0 V时,锑的产率降低的原因可能是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入过量氢氧化钠溶液:![]() +OH-=
+OH-=![]() +H2O
+H2O
B.氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓
C.次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
D.氯化亚铁溶液中加入硝酸:3Fe2++4H++![]() =3Fe3++2H2O+NO↑
=3Fe3++2H2O+NO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗爆剂的添加剂常用1,2-二溴乙烷。如图为实验室制备1,2-二溴乙烷的装置图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
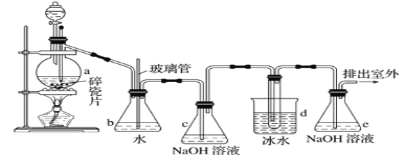
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:①_____________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是②___________________________________;
安全瓶b还可以起到的作用是③___________________________。
(2)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________________。
(3)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正确情况下超过许多,如果装罝的气密性没有问题,试分析可能的原因:_____________________、_____________________________(写出两条即可)。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为________________,要进一步提纯,下列操作中必需的是
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:

(1)A的化学名称是_____________,C中含氧官能团的名称为_____________。
(2)F的结构简式为____________________,A和E生成F的反应类型为______________。
(3)A生成B的化学方程式为__________________________________________________。
(4)写出由C合成D的第二个反应的化学方程式:_________________________________。
(5)同时满足下列条件的E的同分异构体有_________种(不含立体异构)。
①遇FeCl3溶液发生显色反应; ②能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在研究金矿床物质组分的过程中,通过分析发现了Cu—Ni—Zn—Sn—Fe多金属互化物。
(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)
(2)基态Ni2+的核外电子排布式为________;Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点NiO______FeO(填“<”或“>”),其原因是_________________________________________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol (SCN)2分子中含有σ键的数目为________;写出一种与SCN-互为等电子体的分子________(用化学式表示)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为________。

(5)立方NiO(氧化镍)晶体的结构如图所示,其晶胞边长为a pm,列式表示NiO晶体的密度为________g·cm-3(不必计算出结果,阿伏加德罗常数的值为NA)。人工制备的NiO晶体中常存在缺陷(如图):一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。已知某氧化镍样品组成Ni0.96O,该晶体中Ni3+与Ni2+的离子个数之比为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com