
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的电子排布式为____________________。
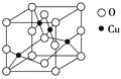
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
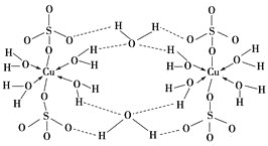
下列说法正确的是________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥型,但NF3不易与Cu2+形成配离子,其原因是______________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因________________。
【答案】(1)1s22s22p63s23p63d9或[Ar]3d9
(2)4
(3)BD
(4)F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子。
(5)高 Cu2O与Cu2S相比,阳离子相同、阴离子所带电荷也相同,但O2-的半径比S2-小,所以Cu2O的晶格能更大,熔点更高。
【解析】
(1)根据Cu的电子排布式书写Cu2+离子的电子排布式;(2)利用均摊法分析晶胞的结构;(3)根据结构示意图中所有氧原子都是饱和氧原子,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,胆矾属于离子晶体以及胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子等角度分析;(4)根据电负性的角度分析;(5)从影响离子晶体熔沸点高低的角度分析。
(1)Cu(电子排布式为:[Ar]3d104s1)Cu2+的过程中,参与反应的电子是最外层的4s及3d上各一个电子,故Cu2+离子的电子排布式是为:[Ar]3d9或1s22s22p63s23p63d9,故答案为:[Ar]3d9或1s22s22p63s23p63d9;(2)从图中可以看出阴离子在晶胞有四类:顶点(8个)、棱上(4个)、面上(2个)、体心(1个),根据立方体的分摊法,可知该晶胞中阴离子数目为:8×![]() +4×
+4×![]() +2×
+2×![]() +1=4;(3)A.硫酸根离子中氧原子并不都是sp3杂化,该结构中的氧原子部分饱和,部分不饱和,杂化方式不同,选项A错误;B.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,选项B正确;C.胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,选项C错误;D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,选项D正确。答案选BD;(4)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,故答案为:F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键。);(5)由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高。
+1=4;(3)A.硫酸根离子中氧原子并不都是sp3杂化,该结构中的氧原子部分饱和,部分不饱和,杂化方式不同,选项A错误;B.在上述结构示意图中,存在O→Cu配位键,H-O、S-O共价键和Cu、O离子键,选项B正确;C.胆矾是五水硫酸铜,胆矾是由水合铜离子及硫酸根离子构成的,属于离子晶体,选项C错误;D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,结合上有着不同,因此受热时也会因温度不同而得到不同的产物,选项D正确。答案选BD;(4)N、F、H三种元素的电负性:F>N>H,所以NH3中共用电子对偏向N,而在NF3中,共用电子对偏向F,偏离N原子,故答案为:F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键。);(5)由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸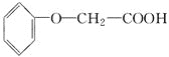 发生酯化反应的产物。
发生酯化反应的产物。
(1)甲一定含有的官能团的名称是________。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是____________________________。
(3)菠萝酯的结构简式是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由Cu片、Zn片和200 mL稀H2SO4组成的原电池中,当Cu片上放出2.24 L(标准状况下)H2时,H2SO4恰好用完。问:
(1)此时在导线上有________摩尔电子通过?
(2)Zn片溶解的质量是________?
(3)原稀H2SO4的物质的量浓度是________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按右图装置进行制取。
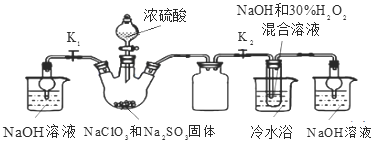
A B C D E
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要_____(填仪器名称);装置C的作用是_____________________。
(2)B中产生ClO2的化学方程式______________________________________。
(3)装置D中反应生成NaClO2的化学方程式为____________________________ 。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有的一种阴离子是_________,检验该离子的方法是___________________________。
(4)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②______________;③______________;④______________;得到成品。
(5)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________;
实验Ⅱ:样品杂质分析与纯度测定
(6)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。
取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是__________________________________________________。
②所称取的样品中NaClO2的物质的量为______________mol(用含c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是
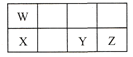
A.原子半径大小:X > Y > Z
B.W、Y两种元素都能与氧元素形成化合物WO2、YO2
C.氧化物对应水化物的酸性: Z > Y > W
D.Y能形成H2Y、H2YO4的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是( )

A.分子中含有三种含氧官能团
B.1 mol该化合物最多能与6molNaOH反应
C.既可以发生取代反应,又能够发生加成反应
D.既能与FeC13发生显色反应,也能和Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500~600℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。

(1)写出仪器的名称:a_______________,b___________________。
(2)A中反应的化学方程式为____________。
(3)装置B中加入的试剂是_____________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置______和 ________(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是___________________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com