
【题目】用胆矾晶体配制500mL0.1mol/L的硫酸铜溶液,需要胆矾的质量为
A. 25g B. 12.5g C. 6.25g D. 37.5g
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。实验室由铬铁矿粉制备重酪酸流程如图所示:

已知步骤①的主要反应为:
![]()
(未配平)。有关物质的溶解度如图所示。

回答下列问题:
(1)滤渣2的主要成分是_________及含硅杂质。
(2)步骤④调滤液2的pH最合适的试剂是______________。
A.H2SO4溶液 B.KOH溶液 C.浓盐酸 D.K2CO3粉末
如何最简单的方法粗略判断pH已调至合适范围_________________。
(3)向“滤液3”中加入适量KCl,蒸发浓缩至_____________________,停止加热,然后冷却结晶,得到的K2Cr2O7固体产品。
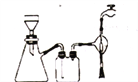
(4)本实验过程中多次用到抽滤的装置,下列关于抽滤的说法正确的是_______。
A.抽滤时,先用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
B.右图抽滤装置中只有2处错误
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀,减小沉淀的损失。
(5)某同学用mg铬铁矿粉(含Cr2O3 40%)制备K2C r2O7,为了测定产率,该同学设计了以下实验:将所有产品加水溶解并定容于500mL容量瓶中,移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加入过量2mol·L-1H2SO4,再加1.1KI,加塞摇匀,充分反应后铬完全以Cr3+存在,于暗处静置5min后,加指示剂,用0.0250mol·L-1标准Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液20.00mL。(已知:2 Na2S2O3+I2=Na2S4O6+2NaI)若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使产量的测量结果__________(填“偏高”“偏低”或“无影响”)。计算该同学的产量_____________x100%(用含是m的式子表示,要求化简,m的系数保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述不正确的是
A. 常温下,铝遇浓硝酸发生钝化 B. 钠在空气中燃烧生成白色的Na20粉末
C. 二氧化硫可以使品红溶液褪色 D. 葡萄糖与银氨溶液在适当条件下可发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述错误的是( ) 
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C.钠着火燃烧产生苍白色火焰
D.若在棉球外沿滴一滴淀粉碘化钾溶液,可根据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中所含化学键类型相同的一组是
A.NaOH、H2SO4、NH4ClB.MgO、Na2SO4、NH4HCO3
C.Na2NO3、KOH、Na2SO4D.AlCl3、Al2O3、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表和元素周期律的说法正确的是()
A. 由于F元素的最低化合价为-1价,故F元素的最高化合价为+7价
B. 第二周期元素从Li到F,非金属性逐渐减弱
C. 由于K比Na容易失去电子,所以K比Na的还原性强
D. 由于H2S的相对分子质量大于H2O的相对分子质量,所以沸点前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ K=1.75×10-5。
CH3COO-+H+ K=1.75×10-5。
(1)计算0.01mol/L的CH3COOH溶液的pH=_________。(已知lg1.75=0.24)
(2)25℃,将0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后溶液的pH=10,则该混合溶液中由水电离出的c(OH-)=___________mol/L,写出该混合溶液中下列算式的精确结果(不能做近似计算),c(Na+)-c(CH3COO-)=______________mol/L。
(3)下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是___________
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量镁粉 f.加入少量0.10 mol·L-1的NaOH溶液
(4)SOCl2是一种液态化合物,向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到剧烈反应,液面上有雾形成,产生可以使品红溶液褪色的气体,往溶液中滴加AgNO3溶液,有白色沉淀析出,请写出SOCl2与水反应的化学方程式______________________________,蒸干AlCl3溶液不能得到无水AlCl3,用SOCl2和AlCl3·6H2O混合加热可以得到无水AlCl3,试解释原因______________________
(5)常温下,反应NH4++HCO3-+H2O ![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为

下列说法正确的是
A. 可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B. 香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应
C. 通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D. 1mol香兰素最多可以与3molH2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com