
【题目】下列关于元素周期表和元素周期律的说法正确的是()
A. 由于F元素的最低化合价为-1价,故F元素的最高化合价为+7价
B. 第二周期元素从Li到F,非金属性逐渐减弱
C. 由于K比Na容易失去电子,所以K比Na的还原性强
D. 由于H2S的相对分子质量大于H2O的相对分子质量,所以沸点前者大于后者
科目:高中化学 来源: 题型:
【题目】对甲基苯胺可用对硝基甲苯在酸性条件下用铁粉还原制得:

主要反应物和产物的物理性质见下表:
化合物 | 物质状态 | 溶解性 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
对硝基甲苯 | 浅黄色晶体 | 不溶于水,溶于乙醇、苯 | 51.4 | 237.7 | 1.286 |
对甲基苯胺 | 白色片状晶体 | 微溶于水,易溶于乙醇、苯 | 43~45 | 200~202 | 1.046 |
对甲基苯胺盐酸盐 | 白色晶体 | 易溶于水,不溶于乙醇、苯 | 243~245 | —— | —— |
苯 | 无色液体 | 不溶于水,溶于乙醇 | 5.5 | 80.1 | 0.874 |
实验流程如下:

请回答下列问题:
(1)反应装置如图,a处缺少一装置_____________(填仪器名称)
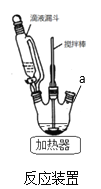
(2)步骤②中加苯的作用是_____________,步骤②中用5%碳酸钠溶液调pH=7~8的原因_________
(3)步骤③得到的固体物质为_________
(4)步骤④中加入盐酸的作用是_____________
(5)步骤⑤中通过加入氢氧化钠溶液使对甲基苯胺结晶析出的原理为_____________
(6
A. 蒸馏水 B.乙醇 C.NaOH溶液 D.HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种元素,已知:①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。请回答:
(1)Y的最高价氧化物对应水化物的化学式是_________________。
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是_________________,此液体具有的性质是______________(填写序号字母)
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼热后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1mol该气体被O2完全氧化放热98.0kJ,若2mol该气体与1molO2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为_____。
②原无色有刺激性气味的气体与含1.5molY的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定装置如图

(1)图中A的名称是:_____________________________
(2)若实验过程中酸碱添加过慢,所得△H将________(填:偏大、偏小或者无影响)
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=_____________(取小数点后一位).
II.为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。

(4)请完成此实验设计,其中:V6=________,V8=___________
(5)该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,请分析主要原因________________________。
III.利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取xmL一定物质的量浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂
步骤Ⅱ:移取ymL BaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
(6)BaCl2溶液的浓度为___________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量盐酸滴至锥形瓶外,Ba2+浓度测量值将______________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体缺铁时,红细胞中血红蛋白的含量会减少,红细胞输送氧的能力也会下降,这种现象说明铁在人体具有下列哪种功能
A. 催化合成血红蛋白的反应 B. 血红蛋白的组成成分
C. 调节细胞中液体的浓度 D. 调节血浆的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com