
【题目】对甲基苯胺可用对硝基甲苯在酸性条件下用铁粉还原制得:

主要反应物和产物的物理性质见下表:
化合物 | 物质状态 | 溶解性 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
对硝基甲苯 | 浅黄色晶体 | 不溶于水,溶于乙醇、苯 | 51.4 | 237.7 | 1.286 |
对甲基苯胺 | 白色片状晶体 | 微溶于水,易溶于乙醇、苯 | 43~45 | 200~202 | 1.046 |
对甲基苯胺盐酸盐 | 白色晶体 | 易溶于水,不溶于乙醇、苯 | 243~245 | —— | —— |
苯 | 无色液体 | 不溶于水,溶于乙醇 | 5.5 | 80.1 | 0.874 |
实验流程如下:

请回答下列问题:
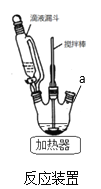
(1)反应装置如图,a处缺少一装置_____________(填仪器名称)
(2)步骤②中加苯的作用是_____________,步骤②中用5%碳酸钠溶液调pH=7~8的原因_________
(3)步骤③得到的固体物质为_________
(4)步骤④中加入盐酸的作用是_____________
(5)步骤⑤中通过加入氢氧化钠溶液使对甲基苯胺结晶析出的原理为_____________
(6
A. 蒸馏水 B.乙醇 C.NaOH溶液 D.HCl溶液
【答案】 球形冷凝管或冷凝管 提取产物和未反应的原料 使Fe3+转化为氢氧化铁沉淀 铁粉和Fe(OH)3 与对甲苯胺反应生成对甲基苯胺盐酸盐进入水层与对硝基甲苯分离 对甲基苯胺盐酸盐与氢氧化钠作用可使对甲苯胺重新游离出来 A
【解析】(1)根据流程图,对硝基甲苯与铁粉和盐酸反应时,需要回流装置,因此反应装置中缺少冷凝管,故答案为:冷凝管;
(2)对甲基苯胺和对硝基甲苯易溶于苯,步骤②中加苯,可以提取产物和未反应的原料,达到与无机试剂的分离,硝基具有比较强的氧化性,能够将铁氧化为铁离子,步骤②中用5%碳酸钠溶液调pH=7~8,可以使Fe3+转化为氢氧化铁沉淀,故答案为:提取产物和未反应的原料;使Fe3+转化为氢氧化铁沉淀;
(3)根据(2)的分析,步骤③得到的固体物质中含有未反应的铁粉和生成的氢氧化铁沉淀,故答案为:铁粉和Fe(OH)3;
(4)抽滤后的液体中含有产物对甲基苯胺,步骤④中加入盐酸,可以与对甲苯胺反应生成对甲基苯胺盐酸盐进入水层与对硝基甲苯分离,故答案为:与对甲苯胺反应生成对甲基苯胺盐酸盐进入水层与对硝基甲苯分离;
(5)步骤⑤中通过加入氢氧化钠溶液,氢氧化钠能够与对甲基苯胺盐酸盐作用生成对甲基苯胺,使对甲基苯胺结晶析出,故答案为:对甲基苯胺盐酸盐与氢氧化钠作用可使对甲苯胺重新游离出来;
(6)对甲基苯胺微溶于水,易溶于乙醇、苯,因此步骤⑥中,最合适的洗涤剂为水,故选A。


科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2molSO2和lmolO2,发生下列反应: 2SO2(g)+ O2(g)![]() 2SO3(g),达到平衡后改变下述条件,再次平衡后SO3气体浓度不变的是
2SO3(g),达到平衡后改变下述条件,再次平衡后SO3气体浓度不变的是
A. 保持温度和容器体积不变,充入1molSO3(g)
B. 保持温度和容器内压强不变,充入1molSO3(g)
C. 保持温度和容器内压强不变,充入1molO2(g)
D. 保持温度和容器内压强不变,充入1molAr(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所示:
序号 | 纯锌粉(g) | 2.0 mol·L-1 硫酸溶液(mL) | 温度 (℃) | 硫酸铜固体(g) | 加入蒸馏水(mL) |
Ⅰ | 2.0 | 50.0 | 25 | 0 | 0 |
Ⅱ | 2.0 | 40.0 | 25 | 0 | 10.0 |
Ⅲ | 2.0 | 50.0 | 25 | 0.2 | 0 |
Ⅳ | 2.0 | 50.0 | 25 | 4.0 | 0 |
①本实验待测数据可以是________________________,实验Ⅰ和实验Ⅱ可以探究________________对锌与稀硫酸反应速率的影响。
②实验Ⅲ和实验Ⅳ的目的是________________,写出有关反应的离子方程式
_______________________________________________________________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:

表中Vx=________mL,理由是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用粗硅(含铁、铝、硼、磷等杂质)与干燥的HCl气体反应制得SiHCl3:Si+3HCl=SiHCl3+H2,SiHCl3与过量的H2在1000℃~1100℃反应制得纯硅。
有关物质的物理常数见下表:
物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | SiHCl3 | PCl5 |
沸点/℃ | 57.7 | 12.8 | — | 315 | 33.0 | — |
熔点/℃ | -70.0 | -107.2 | — | — | -126.5 | — |
升华温度/℃ | — | — | 180 | 300 | 162 |
(1)粗硅与HCl反应完全后,经冷凝得到的SiHCl3中含有少量SiCl4,提纯SiHCl3可采用
___________的方法
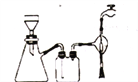
(2)实验室也可用SiHCl3与过量干燥的H2反应制取纯硅,装置如下图所示(加热和夹持装置略去):

①装置B中的试剂是___________,装置C需水浴加热,目的是 ____________________。
②反应一段时间后,装置D中可观察到有晶体硅生成,装置D不能采用普通玻璃管的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。实验室由铬铁矿粉制备重酪酸流程如图所示:

已知步骤①的主要反应为:
![]()
(未配平)。有关物质的溶解度如图所示。

回答下列问题:
(1)滤渣2的主要成分是_________及含硅杂质。
(2)步骤④调滤液2的pH最合适的试剂是______________。
A.H2SO4溶液 B.KOH溶液 C.浓盐酸 D.K2CO3粉末
如何最简单的方法粗略判断pH已调至合适范围_________________。
(3)向“滤液3”中加入适量KCl,蒸发浓缩至_____________________,停止加热,然后冷却结晶,得到的K2Cr2O7固体产品。
(4)本实验过程中多次用到抽滤的装置,下列关于抽滤的说法正确的是_______。
A.抽滤时,先用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
B.右图抽滤装置中只有2处错误
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀,减小沉淀的损失。
(5)某同学用mg铬铁矿粉(含Cr2O3 40%)制备K2C r2O7,为了测定产率,该同学设计了以下实验:将所有产品加水溶解并定容于500mL容量瓶中,移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加入过量2mol·L-1H2SO4,再加1.1KI,加塞摇匀,充分反应后铬完全以Cr3+存在,于暗处静置5min后,加指示剂,用0.0250mol·L-1标准Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液20.00mL。(已知:2 Na2S2O3+I2=Na2S4O6+2NaI)若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使产量的测量结果__________(填“偏高”“偏低”或“无影响”)。计算该同学的产量_____________x100%(用含是m的式子表示,要求化简,m的系数保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表和元素周期律的说法正确的是()
A. 由于F元素的最低化合价为-1价,故F元素的最高化合价为+7价
B. 第二周期元素从Li到F,非金属性逐渐减弱
C. 由于K比Na容易失去电子,所以K比Na的还原性强
D. 由于H2S的相对分子质量大于H2O的相对分子质量,所以沸点前者大于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com