
【题目】纯水在25℃和80℃时氢离子浓度的大小关系是
A.前者大B.相等C.前者小D.不能确定
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。

①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________(填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v正________(填“>”“<”或“=”)v逆。
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是________(填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2 L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10 min内该反应的平均速率v(H2)=________。从第11 min起,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1mol任何气体的体积都为22.4 L
B. 1 mol任何物质在标准状况下所占的体积都为22.4 L
C. 标准状况下,1 mol水所占的体积是22.4 L
D. 标准状况下,22.4 L的任何气体的物质的量都是1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯胺可用对硝基甲苯在酸性条件下用铁粉还原制得:

主要反应物和产物的物理性质见下表:
化合物 | 物质状态 | 溶解性 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
对硝基甲苯 | 浅黄色晶体 | 不溶于水,溶于乙醇、苯 | 51.4 | 237.7 | 1.286 |
对甲基苯胺 | 白色片状晶体 | 微溶于水,易溶于乙醇、苯 | 43~45 | 200~202 | 1.046 |
对甲基苯胺盐酸盐 | 白色晶体 | 易溶于水,不溶于乙醇、苯 | 243~245 | —— | —— |
苯 | 无色液体 | 不溶于水,溶于乙醇 | 5.5 | 80.1 | 0.874 |
实验流程如下:

请回答下列问题:
(1)反应装置如图,a处缺少一装置_____________(填仪器名称)
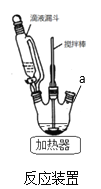
(2)步骤②中加苯的作用是_____________,步骤②中用5%碳酸钠溶液调pH=7~8的原因_________
(3)步骤③得到的固体物质为_________
(4)步骤④中加入盐酸的作用是_____________
(5)步骤⑤中通过加入氢氧化钠溶液使对甲基苯胺结晶析出的原理为_____________
(6
A. 蒸馏水 B.乙醇 C.NaOH溶液 D.HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.NaClO c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A. ③⑤⑥ B. ①③⑤ C. ①②④ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有15 g A物质与10.5 g B物质恰好完全反应,生成7.2 g C物质、1.8 g D物质和0.3 mol E物质。则E的摩尔质量是
A. 27.5 g·mol-1 B. 55 g·mol-1 C. 100 g·mol-1 D. 111 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g)![]() N2O4(g) △H<0]:
N2O4(g) △H<0]:
容器 | 物质 | 起始浓度/(mol | 平衡浓度/(mol |
Ⅰ | N2O4 | 0.100 | 0.040 |
NO2 | 0 | 0.120 | |
Ⅱ | N2O4 | 0 | 0.0142 |
NO2 | 0.100 | 0.0716 |
下列说法不正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应的转化率a(N2O4)>a(NO2)
B. 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ)
C. 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(I)=![]()
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1![]() 二元弱酸
二元弱酸![]() 溶液的pH,溶液中的
溶液的pH,溶液中的![]() 、
、![]() 、
、![]() 的物质的量分数
的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是( )
A. pH=1.2时, ![]()
B. ![]()
C. pH=2.7时, ![]()
D. pH=4.2时, ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com