
【题目】常温下,向某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的 或
或 与pH变化的关系如图所示。下列叙述正确的是
与pH变化的关系如图所示。下列叙述正确的是![]()

A.M线表示 随pH的变化
随pH的变化
B.BR溶液呈碱性
C.若温度升高,两条线均向上平移
D.常温下,![]() 溶液的
溶液的![]()
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】为了实现资源利用最大化,某化工厂将合成氨、制纯碱和生产尿素![]() 工艺联合,简易流程如下:
工艺联合,简易流程如下:
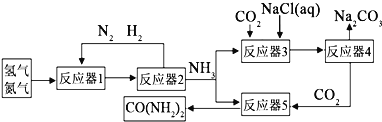
![]() 时101kPa时,测得生成17g
时101kPa时,测得生成17g![]() ,放出
,放出![]() 热量,写出合成
热量,写出合成![]() 的热化学方程式 ______ .
的热化学方程式 ______ .
![]() 合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 ______ .
合成氨原料气中的杂质硫化氢用稀氨水吸收,副产品是酸式盐.该副产品的化学式为 ______ .
![]() 反应器2分离出来的氮气和氢气再通入反应器1,其目的是 ______
反应器2分离出来的氮气和氢气再通入反应器1,其目的是 ______ ![]() 向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得
向反应器3充入原料的顺序是:先加氯化钠溶液,通入氨气至饱和,再通入足量的二氧化碳可制得![]() 反应器3中的化学方程式为 ______ .
反应器3中的化学方程式为 ______ .
![]() 工业上可用碳、甲烷与水蒸汽反应制氢气
工业上可用碳、甲烷与水蒸汽反应制氢气
![]() ,
,![]() ,此反应的化学平衡常数表达式为
,此反应的化学平衡常数表达式为![]() ______ ,为了提高碳的转化率,宜采用下列措施中的
______ ,为了提高碳的转化率,宜采用下列措施中的![]() 填字母编号
填字母编号![]() ______ .
______ .
A.增大压强![]() 增加碳的量
增加碳的量![]() 升高温度
升高温度![]() 增加水的量
增加水的量![]() 使用催化剂
使用催化剂![]() 及时移出CO、
及时移出CO、![]()
![]() 有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 ______ .
有些国家水电丰富,采用惰性电极电解硫酸钠溶液制氢气,电解时阳极上的电极反应式为 ______ .
![]() 若仅以
若仅以![]() 、空气、
、空气、![]() 为原料制尿素
为原料制尿素 ,标准状况下
,标准状况下![]()
![]() ,理论上最多能制 ______
,理论上最多能制 ______ ![]() 尿素.
尿素.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法与盐类的水解有关的是![]()
①明矾和![]() 可作净水剂;
可作净水剂;
②实验室盛放![]() 、
、![]() 等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞;
等溶液的试剂瓶应用橡皮塞,而不能用玻璃塞;
③长期施用硫酸铵,土壤酸性增强;
④![]() 与
与![]() 溶液可作焊接中的除锈剂;
溶液可作焊接中的除锈剂;
⑤草木灰与铵态氮肥不能混合施用;
⑥用![]() 与
与![]() 两种溶液可作泡沫灭火剂。
两种溶液可作泡沫灭火剂。
A.①④B.②⑥C.③⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
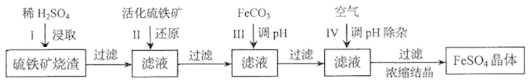
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是_____________________。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择_________________(填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是_______________。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=Fe+2Li2S,正极反应式是___________。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)H=-1648kJ/mol
C(s)+O2(g)=CO2(g)H =-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)H =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______________。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3___________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol·L-1盐酸与50mL0.55 mol·L -1NaOH 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是

A. 在测定中和热的实验中,至少需要测定并记录的温度是3次
B. 大烧杯上如不盖硬纸板,测得的中和热数值会偏小
C. 用相同浓度和体积的氨水代替NaOH 溶液进行上述实验,测得中和热的数值会偏大
D. 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与稀HCl反应制CO2,实验过程记录如右图所示。根据分析、判断,正确的是( )
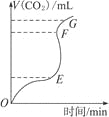
A.OE段表示的反应速率最快
B.EF段表示的反应速率最快,收集的CO2最多
C.FG段收集的CO2最多
D.OG段表示随着时间的推移,反应速率逐渐增快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
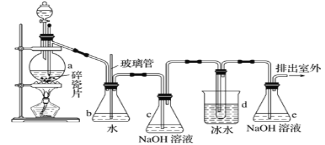
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)装置a中发生主要反应的方程式为:___。为防止副反应发生,实验中的具体操作为:___。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,如果实验时d装罝中导管堵塞,你认为可能的原因:___;安全瓶b还可以起到的作用是:___。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是___。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比理论值超过许多,如果装罝的气密性没有问题,试分析可能的原因:___、___(写出两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO45H2O)和副产物石膏(CaSO42H2O)的生产流程示意图:
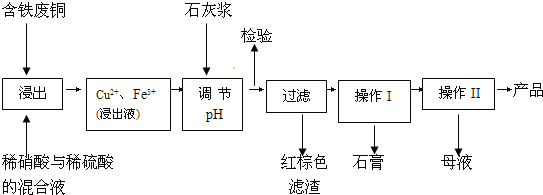
胆矾和石膏在不同温度下的溶解度(g/100g水)见表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是___;
(2)写出浸出过程中生成硫酸铜的离子方程式___;
(3)操作I包括蒸发浓缩、__等操作,温度应该控制在__℃左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为__、___、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是__;干燥时采用晾干,不用加热烘干的原因是___。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是__;
②指出你认为不合理方案存在的问题是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com