
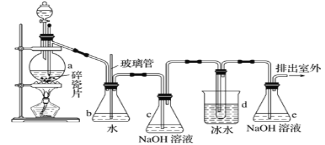
【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)装置a中发生主要反应的方程式为:___。为防止副反应发生,实验中的具体操作为:___。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,如果实验时d装罝中导管堵塞,你认为可能的原因:___;安全瓶b还可以起到的作用是:___。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是___。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比理论值超过许多,如果装罝的气密性没有问题,试分析可能的原因:___、___(写出两条即可)。
【答案】CH3-CH2-OH ![]() CH2=CH2↑+H2O 将温度迅速升高到170℃ 过度冷却,产品1,2-二溴乙烷在装罝d中凝固 防止倒吸 吸收乙烯气体中含有的CO2、SO2等酸性气体 浓硫酸将部分乙醇氧化;发生副反应生成乙醚; 乙醇挥发;乙烯流速过快,未完全发生加成反应
CH2=CH2↑+H2O 将温度迅速升高到170℃ 过度冷却,产品1,2-二溴乙烷在装罝d中凝固 防止倒吸 吸收乙烯气体中含有的CO2、SO2等酸性气体 浓硫酸将部分乙醇氧化;发生副反应生成乙醚; 乙醇挥发;乙烯流速过快,未完全发生加成反应
【解析】
(1)根据乙烯能和溴水反应生成1,2-二溴乙烷分析,装置中先制取乙烯气体,据此书写方程式。
(2)根据反应过程中可能存在的副反应分析实验的注意事项。
(3)根据乙烯气体中可能的杂质气体为二氧化碳和二氧化硫等分析氢氧化钠的作用。
(4)根据浓硫酸具有强氧化性和乙醇具有挥发性等分析。
(1) 装置a中为乙醇在浓硫酸条件下反应生成乙烯,方程式为:CH3-CH2-OH ![]() CH2=CH2↑+H2O,因为乙醇加热到140度时可以反应生成乙醚,所以为了防止副反应发生,实验中具体操作为将温度迅速升高到170℃;
CH2=CH2↑+H2O,因为乙醇加热到140度时可以反应生成乙醚,所以为了防止副反应发生,实验中具体操作为将温度迅速升高到170℃;
(3)装置d中发生堵塞,可能是因为过度冷却,产品1,2-二溴乙烷在装罝d中凝固;后面的液体可能倒吸到安全瓶b中,但不可能倒吸回反应装置中,所以可以防止倒吸;
(4)氢氧化钠能吸收二氧化碳或二氧化硫等酸性气体,故其作用为:吸收乙烯气体中含有的CO2、SO2等酸性气体;
(5)反应过程中浓硫酸具有强氧化性,可能将部分乙醇氧化;或因为温度控制不当,发生副反应生成乙醚;或因为乙醇挥发造成产物量减少;或因为乙烯流速过快,未完全发生加成反应。


科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 向淀粉的酸性水解液中滴入少量新制Cu(OH)2悬浊液并加热 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B | NaAlO2溶液与NaHCO3溶液混合 | 白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 的△H<0 |
D | 向盛有1mL0.l mol/L的AgNO3溶液中加入10滴0.1mol/L的NaCl溶液,振荡,再加入10滴0.1mol/L的NaI溶液,再振荡 | 先生成白色沉淀,后产生黄色沉淀 | Ksp(AgI)sp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的 或
或 与pH变化的关系如图所示。下列叙述正确的是
与pH变化的关系如图所示。下列叙述正确的是![]()

A.M线表示 随pH的变化
随pH的变化
B.BR溶液呈碱性
C.若温度升高,两条线均向上平移
D.常温下,![]() 溶液的
溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将![]() 、NO、
、NO、![]() 混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内
混合并充满容器,然后把容器倒置于水槽中,充分反应后,水充满容器,则容器内![]() 的物质的量浓度的大小范围是( )
的物质的量浓度的大小范围是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H1=﹣55.7kJ/mol
②2CH3OH(l)═CH3OCH3(g)+H2O(l)△H2=﹣23.4kJ/mol
③CO2(g)+H2(g)═CO(g)+H2O(l) △H3
④H2O(l)=H2O(g) △H4=+44.0kJ/mol
(1)已知反应CO2(g)+H2(g)=CO(g)+H2O(g)△H,中相关的化学键键能数据如下:

由此计算△H=______,则△H3=_______。
(2)CO2(g)加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式是___。
(3)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如图所示,图中A点和B点的平衡常数比较:KA___KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律:a.___。b.___。
(4)常温常压下,向一个2.00L的密闭恒容容器中加入等量2.00mol二氧化碳和氢气,平衡时二甲醚的浓度为0.150mol/L,计算此时二氧化碳的转化率及该反应的平衡常数,要求写出计算过程(计算结果保留3位有效数字)________、_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,下列关系式正确的是
时,下列关系式正确的是
A.![]() 的
的![]() 溶液与
溶液与![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
B.盐酸与![]() 的混合溶液
的混合溶液![]() ,稀释10倍后:
,稀释10倍后:![]()
C.pH相同的①![]() ;②
;②![]() ;③
;③![]() 三种溶液稀释后
三种溶液稀释后![]() :②>①>③
:②>①>③
D.同浓度的①NH4HSO4 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 ④NH4HCO3 ⑤(NH4)2CO3溶液中![]() 的浓度由大到小的顺序为③>②>⑤>④>①
的浓度由大到小的顺序为③>②>⑤>④>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4.。下列判断正确的是
xC(g);ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4.。下列判断正确的是

A. x=4
B. 若N中气体的密度如图Ⅲ所示,则A、B可能都是气态
C. 若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以环戊烷为原料制备环戊二烯的合成路线如图,则下列说法正确的是( )
![]()
A. A的结构简式是![]()
B. ①②的反应类型分别是取代、消去
C. 反应②③的条件分别是浓硫酸加热、光照
D. 加入酸性KMnO4溶液,若溶液褪色则可证明![]() 已完全转化为
已完全转化为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com