
【题目】![]() 时,下列关系式正确的是
时,下列关系式正确的是
A.![]() 的
的![]() 溶液与
溶液与![]() 的
的![]() 溶液等体积混合:
溶液等体积混合:![]()
B.盐酸与![]() 的混合溶液
的混合溶液![]() ,稀释10倍后:
,稀释10倍后:![]()
C.pH相同的①![]() ;②
;②![]() ;③
;③![]() 三种溶液稀释后
三种溶液稀释后![]() :②>①>③
:②>①>③
D.同浓度的①NH4HSO4 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 ④NH4HCO3 ⑤(NH4)2CO3溶液中![]() 的浓度由大到小的顺序为③>②>⑤>④>①
的浓度由大到小的顺序为③>②>⑤>④>①
【答案】B
【解析】
A.![]() 时,
时,![]() 的硫酸中
的硫酸中![]() =10-3mol/L,
=10-3mol/L,![]() 的氨水中c(OH-)=10-3mol/L,由于一水合氨存在电离平衡,所以氨水的浓度大于硫酸的浓度;二者等体积混合氨水有大量剩余,一水合氨电离程度大于铵根离子水解程度,导致溶液呈碱性,则
的氨水中c(OH-)=10-3mol/L,由于一水合氨存在电离平衡,所以氨水的浓度大于硫酸的浓度;二者等体积混合氨水有大量剩余,一水合氨电离程度大于铵根离子水解程度,导致溶液呈碱性,则![]() ,根据电荷守恒得
,根据电荷守恒得![]() ,故A错误;
,故A错误;
B.![]() 的盐酸稀释10倍后
的盐酸稀释10倍后![]() ,加水稀释促进FeCl2水解,导致稀释10倍后溶液中
,加水稀释促进FeCl2水解,导致稀释10倍后溶液中![]() ,则溶液的
,则溶液的![]() ,故B正确;
,故B正确;
C.同pH的![]() 与
与![]() 溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者
溶液中,都是强酸弱碱盐,根据溶液呈电中性可判断二者![]() 浓度相等,由于
浓度相等,由于![]() 电离时产生
电离时产生![]() 而抑制
而抑制![]() 水解,因此
水解,因此![]() 中
中![]() 的浓度小于
的浓度小于![]() ,三种溶液的
,三种溶液的![]() :
:![]() ,故C错误;
,故C错误;
D.![]() 中
中![]() 抑制
抑制![]() 水解,
水解,![]() 中
中![]() 抑制
抑制![]() 水解,
水解,![]() 中
中![]() 促进水解
促进水解![]() ,
,![]() 中
中![]() 促进
促进![]() 水解,如果相同化学式中
水解,如果相同化学式中![]() 水解程度越大溶液中
水解程度越大溶液中![]() 越小,同浓度的下列溶液中
越小,同浓度的下列溶液中![]() 的浓度由大到小的顺序为
的浓度由大到小的顺序为![]() ,故D错误;
,故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与稀HCl反应制CO2,实验过程记录如右图所示。根据分析、判断,正确的是( )
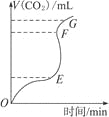
A.OE段表示的反应速率最快
B.EF段表示的反应速率最快,收集的CO2最多
C.FG段收集的CO2最多
D.OG段表示随着时间的推移,反应速率逐渐增快
查看答案和解析>>
科目:高中化学 来源: 题型:
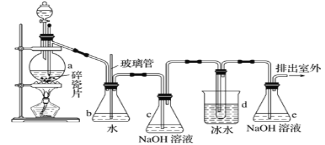
【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)装置a中发生主要反应的方程式为:___。为防止副反应发生,实验中的具体操作为:___。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,如果实验时d装罝中导管堵塞,你认为可能的原因:___;安全瓶b还可以起到的作用是:___。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是___。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比理论值超过许多,如果装罝的气密性没有问题,试分析可能的原因:___、___(写出两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
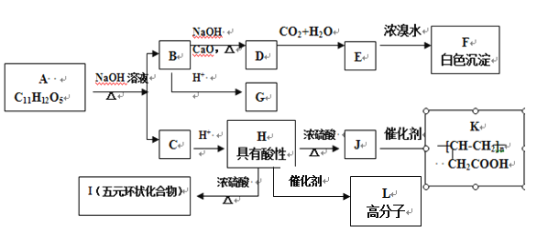
【题目】某芳香族化合物A,与碳酸钠溶液反应生成CO2,遇FeCl3溶液显色,A分子结构中不含甲基,苯环上的一氯代物只有两种, A和其他有机物存在如下图所示的转化关系:
已知: ![]() +NaOH
+NaOH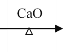 R—H + Na2CO3
R—H + Na2CO3
试回答下列问题:
(1)D化学式___。
(2)H→L反应类型为___,J所含官能团的名称为___。
(3)写出H→I反应的化学方程式___。
(4)A的结构简式___。
(5)用系统命名法命名F___,F同分异构体中含有苯环且官能团相同的物质共有___种(不包括F),其中核磁共振氢谱有两个峰,且峰面积比为1︰2的是___(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积pH=2的NaHSO4溶液中,逐滴加入一定物质的量浓度的Ba(OH)2溶液,当溶液中的硫酸根恰好完全沉淀时,溶液的pH=11,若反应后溶液的体积等于反应的两溶液的体积之和,则NaHSO4溶液与Ba(OH)2溶液的体积比为
A.1:9B.1:1C.1:2D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是______________________________。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是__________(填离子符号)。
(3)周期表中有些处于对角线(左上→右下)位置的元素,它们的单质及其化合物的性质相似,则M的氧化物与强碱溶液反应的离子方程式______________________________。
(4)Q和R按原子个数比1:1组成的化合物甲是一种“绿色”氧化剂。
①甲中所含共价键类型是____________________。
②空气阴极法电解制备甲的装置如图所示。在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。图中a是__________极,阴极的电极反应式是____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是一种应用极其广泛的化工原料;以下是某工厂用含铁废铜为原料生产胆矾(CuSO45H2O)和副产物石膏(CaSO42H2O)的生产流程示意图:
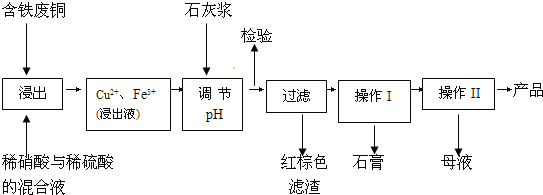
胆矾和石膏在不同温度下的溶解度(g/100g水)见表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是___;
(2)写出浸出过程中生成硫酸铜的离子方程式___;
(3)操作I包括蒸发浓缩、__等操作,温度应该控制在__℃左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为__、___、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是__;干燥时采用晾干,不用加热烘干的原因是___。
(5)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液; 方案二:纸层析→喷KSCN溶液;
①你认为上述两种方案设计更合理的是__;
②指出你认为不合理方案存在的问题是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物 A 的产量可以用来衡量一个国家的石油化工发展水平,B 和 D 是生活中两种常见的有机物。现以 A 为主要原料合成乙酸乙酯,其合成路线如图 1 所示。

(1)B 分子中官能团的名称是____,反应①的反应类型是____反应;
(2)反应②的化学方程式是____,反应④的化学方程式是____;
(3)E 是常见的高分子材料,E 的结构简式是____;
(4)某同学用如图 2 所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。实验时,甲中饱和碳酸钠溶液的作用是(填字母)____。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.加速酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com