
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃24mL,与过量氧气混合并完全燃烧,通过浓硫酸后,恢复到原来的温度和压强,气体总体积缩小了54mL,原混合烃中乙炔的体积分数为( )
A.75%B.50%C.25%D.20%
【答案】C
【解析】
发生的反应分别为:2C2H6+7O2![]() 4CO2+6H2O、2C2H2+5O2
4CO2+6H2O、2C2H2+5O2![]() 4CO2+2H2O、2C3H6+9O2
4CO2+2H2O、2C3H6+9O2![]() 6CO2+6H2O,除去水蒸气,恢复到原来的温度和压强,根据反应方程式可知,相同体积的C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质,设C2H6和C3H6一共为xmL,C2H2为ymL,列方程计算,进而计算乙炔的体积分数。
6CO2+6H2O,除去水蒸气,恢复到原来的温度和压强,根据反应方程式可知,相同体积的C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质,设C2H6和C3H6一共为xmL,C2H2为ymL,列方程计算,进而计算乙炔的体积分数。
除去水蒸气,恢复到原来的温度和压强,水为液态,则:
2C2H6+7O2![]() 4CO2+6H2O △V
4CO2+6H2O △V
2 7 4 5
2C2H2+5O2![]() 4CO2+2H2O△V
4CO2+2H2O△V
2 5 4 3
2C3H6+9O2![]() 6CO2+6H2O △V
6CO2+6H2O △V
2 9 6 5
相同体积的C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质,设C2H6和C3H6一共为xmL,C2H2为ymL,则有:x+y=24、![]() +
+![]() =54,解得x=18、y=6,混合烃中乙炔的体积分数为
=54,解得x=18、y=6,混合烃中乙炔的体积分数为![]() ×100%=25%;
×100%=25%;
答案为C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】中草药秦皮中含有的七叶树内酯(每个折点表示一个碳原子,氢原子未画出),具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
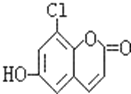
A.2molBr2、2molNaOHB.3molBr2、4molNaOH
C.3molBr2、5molNaOHD.4molBr2、5molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:6g碳不完全燃烧所得产物中,CO与CO2的体积比为2∶3,且:C(s)+O2(g)=CO(g) ΔH=-110.35kJ·mol-1 CO(g)+O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1。与6g碳完全燃烧相比,损失的热量为( )
A.56.51kJB.110.35kJC.196.46kJD.282.57kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1mol/L NH4Al(SO4)2中c(NH4+) ______ ![]() 填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
填“等于”、“大于”或“小于”0.1mol/LNH4HSO4中c(NH4+)。
(2)如图是0.1mol/L电解质溶液的pH随温度变化的图象:
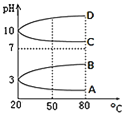
①其中符合0.1mol/L NH4Al(SO4)2的pH随温度变化的曲线是 ______ (填写字母);
②20℃时,0.1mol/L NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______mol/L
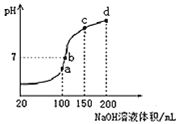
(3)室温时,向100mL0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ______ ;在b点,溶液中各离子浓度由大到小的排列顺序是 ______
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)当溶液pH=5时,某溶液中的Al3+ ______ ![]() 填“能”或“不能”
填“能”或“不能”![]() 完全沉淀(溶液中的离子浓度小于1×10-5mol/L时,沉淀完全)
完全沉淀(溶液中的离子浓度小于1×10-5mol/L时,沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,在“
时,在“![]() ”的水溶液体系中,
”的水溶液体系中,![]() ,
,![]() 和
和![]() 三者中各自所占的物质的量分数
三者中各自所占的物质的量分数![]() 随溶液pH变化的关系如图所示。下列说法正确的是
随溶液pH变化的关系如图所示。下列说法正确的是
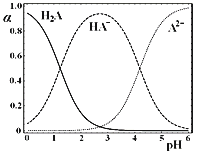
A.在含![]() A、
A、![]() 和
和![]() 的溶液中,加入少量NaOH固体,
的溶液中,加入少量NaOH固体,![]() 一定增大
一定增大
B.将等物质的量的NaHA和![]() 混合物溶于水,所得溶液中
混合物溶于水,所得溶液中![]()
C.NaHA溶液中,![]() 的水解能力大于
的水解能力大于![]() 的电离能力
的电离能力
D.在含![]() A、
A、![]() 和
和![]() 的溶液中,若
的溶液中,若![]() ,则
,则![]() 与
与![]() 不一定相等
不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬矿石(主要成分为Cr2O3,还有Al2O3、SiO2等杂质)为原料制取红矾钠 (Na2Cr2O7·2H2O)的流程如图所示。
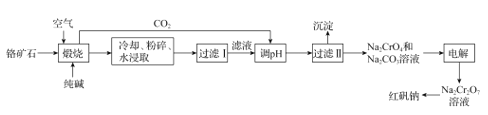
已知:I.Cr2O3在碱性条件下易被氧化;
II.高温条件下,Al2O3与Na2CO3发生的反应为:Al2O3 +Na2CO3=2NaAlO2 +CO2↑;
III.2CrO42-+2H+![]() Cr2O72- +H2O K=1.0×1012
Cr2O72- +H2O K=1.0×1012
(1)“煅烧”时,Cr2O3参加反应的化学方程式为_____。若“煅烧”操作最适宜的温度是800~900℃,则在实验室中进行此项操作时,应选择_____坩埚(填字母)。
a.陶瓷 b.玻璃 c.石英 d.铁
(2)流程中可循环利用的物质除CO2外还有_____(填化学式)。
(3)“过滤II”所得沉淀主要有______(填化学式)。
(4)由Na2Cr2O7溶液制备红矾钠的具体实验操作有_____,经洗涤、干燥得到红矾钠样品。
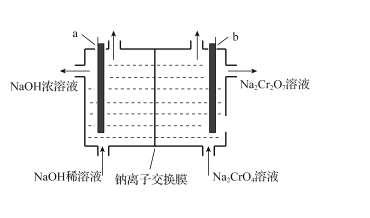
(5)“电解”时,利用以下装置将Na2CrO4溶液转化为Na2Cr2O7溶液,当a、b均为石墨电极时,a电极的电极反应式为____。若初始加入电解池中的c (Na2CrO4)=1.0mol·L-l,随着“电解”的进行,当溶液pH=6时,Na2CrO4的转化率为______(忽略电解过程中溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是( )
)的说法正确的是( )
A.a、b、c的分子式均为C8H8
B.a、b、c中只有a的所有原子可能处于同一平面
C.a、b、c的一氯代物中,b有1种,a、c均有5种(不考虑立体异构)
D.a、b、c均能与溴水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,不溶于水,易溶于醇等有机溶剂。实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O
CH2=CH2+H2O
CH2=CH2+Br2→BrCH2CH2Br
已知:①乙醇在浓硫酸存在下在140℃脱水生成乙醚
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
②实验中常因温度过高而使乙醇和浓硫酸反应生成少量SO2和CO2,用12.0g溴和足量的乙醇制备1,2-二溴乙烷,实验装置如图所示:
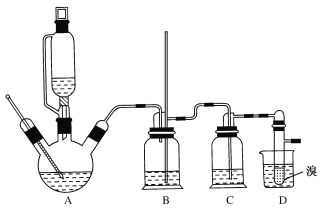
有关数据列表如下:
类别 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,A中按最佳体积比3﹕1加入乙醇与浓硫酸后,A中还要加入几粒碎瓷片,其作用是___。要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是___。
(2)装置B的作用是作安全瓶,瓶中盛水,除了可以防止倒吸以外,还可判断装置是否堵塞,若堵塞,B中现象是____。
(3)在装置C中应加入NaOH溶液,其目的是____。
(4)装置D中小试管内盛有液溴,判断该制备反应已经结束的最简单方法是___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___层(填“上”或“下”)。若产物中有少量未反应的Br2,最好用___洗涤除去;若产物中有少量副产物乙醚,可用____(填操作方法名称)的方法除去。
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是___。
(7)若实验结束后得到9.4g产品,1,2—二溴乙烷的产率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下,pH=4的CH3COOH溶液中,由水电离的c(H+) = 10-10 mol/L
B. 将pH=2的HCl溶液和pH=4的H2SO4溶液等体积混合,所得溶液pH=3
C. 0.1 mol/L氨水和0.1 mol/L NH4Cl溶液等体积混合后所得溶液pH>7,则c(NH4+) < c(NH3·H2O)
D. 向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液反应的离子方程式为:HA-+ OH- = H2O + A2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com