
【题目】已知:6g碳不完全燃烧所得产物中,CO与CO2的体积比为2∶3,且:C(s)+O2(g)=CO(g) ΔH=-110.35kJ·mol-1 CO(g)+O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1。与6g碳完全燃烧相比,损失的热量为( )
A.56.51kJB.110.35kJC.196.46kJD.282.57kJ
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】![]() 时,向
时,向![]() 溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述不正确的是
溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述不正确的是![]()

A.C点溶液中含有![]() 和
和![]()
B.![]() 溶液中水的电离程度比
溶液中水的电离程度比![]() 溶液中小
溶液中小
C.B点,![]()
D.D点,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下列材料,完成下列小题。
戴维发现Cl2的反应为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O。多余的Cl2可用NaOH溶液吸收。液氯用于自来水消毒已成为目前给水系统中最为经济有效的消毒技术,但其消毒后生成的副产物对人体存在健康隐患。ClO2是一种易溶于水的气体,是国际上公认的高效、安全、无毒的绿色消毒剂。
MnCl2+Cl2↑+2H2O。多余的Cl2可用NaOH溶液吸收。液氯用于自来水消毒已成为目前给水系统中最为经济有效的消毒技术,但其消毒后生成的副产物对人体存在健康隐患。ClO2是一种易溶于水的气体,是国际上公认的高效、安全、无毒的绿色消毒剂。
【1】戴维发现Cl2的反应中,还原剂是
A.MnO2B.HClC.MnCl2D.Cl2
【2】从氧化还原反应的角度分析,下列物质中不可以替代MnO2的是
A.O2B.NaClO3C.NaClOD.NaCl
【3】Cl2被NaOH溶液吸收时会生成NaClO。NaClO属于
A.酸B.碱C.盐D.氧化物
【4】下列物质中可以替代NaOH溶液吸收Cl2的是
A.石灰乳B.食盐水C.浓硫酸D.稀盐酸
【5】实验室收集ClO2可以采用的方法是
A.![]() B.
B.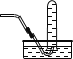 C.
C.![]() D.
D.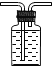
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“位置”、“结构”和“性质”是我们学习元素周期律的重要思路。
(1)我们可以根据原子结构示意图来推测元素在周期表中的位置,以下为X元素的原子结构示意图(未画全):
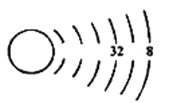
请写出X元素在周期表中的位置_____________________。
(2)我们也可以根据物质性质推测该元素在元素周期表中的位置,如Y元素最高价氧化物既可以溶于浓盐酸,也可以溶于NaOH溶液;其最高价氧化物对应的水化物既可以与酸反应,也可以与碱反应;1mol该元素最高价氧化物对应的水化物在与盐酸反应时,最多能消耗4molHCl。请写出Y元素在周期表中的位置_____________________。
(3)反过来,知道了元素的位置关系,我们可以推测元素性质或者元素对应的单质及化合物的性质。四种短周期元素在周期表中的位置如下图所示,其中只有M为金属元素。则Y和Z原子半径更大的是____(填元素符号或化学式,下同),Y和X最高价氧化物对应水化物的酸性更弱的是______。
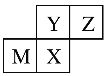
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 常温下某溶液中由水电离出的离子浓度符合
常温下某溶液中由水电离出的离子浓度符合![]() 的溶液,其pH为 ______ ,此时水的电离受到 ______ .
的溶液,其pH为 ______ ,此时水的电离受到 ______ .
![]() 已知:
已知:![]() 一定温度下,在密闭容器中反应
一定温度下,在密闭容器中反应![]() 达到平衡.其他条件不变时,下列措施能提高
达到平衡.其他条件不变时,下列措施能提高![]() 转化率的是 ______
转化率的是 ______ ![]() 填字母
填字母![]() .
.
A.减小![]() 的浓度
的浓度![]() 降低温度
降低温度![]() 增加
增加![]() 的浓度
的浓度![]() 升高温度
升高温度
![]() 在某温度下,
在某温度下,![]() 的离子积常数为
的离子积常数为![]()
![]() ,则该温度下:
,则该温度下:
![]() 溶液的
溶液的![]() ______ ;
______ ;
![]()
![]() 溶液与100mL
溶液与100mL![]() 的KOH溶液混合后,
的KOH溶液混合后,![]() _____
_____
![]() 已知一溶液有4种离子:
已知一溶液有4种离子:![]() 、
、![]() 、
、![]() 、
、![]() ,下列分析结果肯定错误的是 ______
,下列分析结果肯定错误的是 ______
A.![]()
![]()
C.![]()
![]()
![]() 在
在![]() 下,将a
下,将a![]() 的氨水与
的氨水与![]() 的盐酸等体积混合,反应时溶液中
的盐酸等体积混合,反应时溶液中![]() 则溶液显 ______
则溶液显 ______ ![]() 填“酸”“碱”或“中”
填“酸”“碱”或“中”![]() 性;用含a的代数式表示
性;用含a的代数式表示![]() 的电离常数
的电离常数![]() ______ .
______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如图。
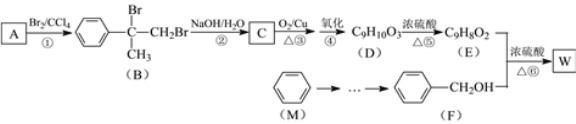
已知:![]() +CH3Cl
+CH3Cl![]()
![]() +HCl
+HCl
请回答下列问题:
(1)A的化学式是___,F的化学名称是___。
(2)②和⑤的反应类型分别____、____。
(3)E中含氧官能团是___(写名称),D聚合生成高分子化合物的结构简式为___。
(4)写出反应⑥的化学方程式:___。
(5)反应③的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为_____.
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____,B原子的杂化轨道类型是_____.
Li、B、H元素的电负性由大到小排列顺序为_____.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol﹣1 | I2/kJmol﹣1 | I3/kJmol﹣1 | I4/kJmol﹣1 | I5/kJmol﹣1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____(填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____,NaH的理论密度是___________gcm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃24mL,与过量氧气混合并完全燃烧,通过浓硫酸后,恢复到原来的温度和压强,气体总体积缩小了54mL,原混合烃中乙炔的体积分数为( )
A.75%B.50%C.25%D.20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链烃A的核磁共振氢谱显示只含有一种氢原子,A的质谱图中显示其最大质荷比为84,A的红外光谱表明分子中含有碳碳双键。
(1)A的结构简式为____。
(2)在图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
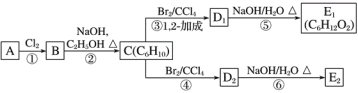
C的化学名称是___;反应⑤的化学方程式为____;E2的结构简式是____;②、⑥的反应类型依次____、___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com