
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下:

(1)写出上述实验过程中所用试剂(写化学式):
试剂②_____________________;试剂③_____________________。
(2)判断试剂①已过量的方法是:___________________________________。
(3)用离子方程式表示加入试剂②的作用:________________________
(4)操作①是利用半透膜进行分离提纯。
操作①的实验结果:淀粉_________(填“能”或“不能”)透过半透膜;SO42-__________(填“能”或“不能”)透过半透膜;
请用实验证明上述结果,完成下表(可不填满,也可增加)______:
限选试剂:1mol/L AgNO3溶液、1mol/L BaCl2溶液、1mol/L Ba(NO3)2溶液、碘水、稀盐酸、稀硝酸
编号 | 实验操作 | 预期现象和结论 |
① | ||
② |
【答案】BaCl2 HCl 静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量 Ba2++CO32-=BaCO3↓ Ca2++CO32-=CaCO3↓ 不能 能
编号 | 实验操作 | 预期现象和结论 |
① | 取半透膜外液体,加入少量碘水 | 液体没有变成蓝色,证明淀粉不能透过半透膜 |
② | 另取半透膜外液体,加入足量稀盐酸和少量1mol/L BaCl2溶液 | 产生不溶于盐酸的白色沉淀,证明SO42-能够透过半透膜 |
【解析】
胶体不能透过半透膜,操作①为渗析;除去粗盐中含有的Ca2+、SO42-可溶性杂质的方法:加入过量BaCl2,除去硫酸根离子;再加入过量Na2CO3(去除钙离子和过量的钡离子),则试剂①为BaCl2,操作②为过滤,沉淀A为硫酸钡,试剂②为Na2CO3,操作③为过滤,沉淀B为碳酸钙和碳酸钡,试剂③为盐酸,加入盐酸可除去过量的Na2CO3,最后蒸发结晶可得到NaCl晶体,以此解答该题。
(1)由以上分析可知试剂①为BaCl2,试剂③为HCl;
(2)由于硫酸钡是不溶于水也不溶于酸的白色沉淀,则判断试剂①已过量的方法是静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量;
(3)试剂②为Na2CO3,加入试剂②的作用是除去溶液中钙离子和过量的钡离子,反应的离子方程式为Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓;
(4)胶体粒子和浊液粒子半径比较大,不能透过半透膜,而溶质粒子可通过半透膜,即淀粉不能透过半透膜,SO42-能透过半透膜;检验淀粉,可取半透膜外液体,加入少量碘水,液体没有变成蓝色,证明淀粉不能透过半透膜,检验SO42-,可另取半透膜外液体,加入足量稀盐酸和少量1mol/L BaCl2溶液,产生不溶于盐酸的白色沉淀,证明SO42-能够透过半透膜,即
编号 | 实验操作 | 预期现象和结论 |
① | 取半透膜外液体,加入少量碘水 | 液体没有变成蓝色,证明淀粉不能透过半透膜 |
② | 另取半透膜外液体,加入足量稀盐酸和少量1mol/L BaCl2溶液 | 产生不溶于盐酸的白色沉淀,证明SO42-能够透过半透膜 |


科目:高中化学 来源: 题型:
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是 ( )
A. 沉淀中氢氧根的质量为(n-m)克
B. 恰好溶解后溶液中的NO3-离子的物质的量为![]() mol
mol
C. 生成标准状况下NO气体的体积为![]() L
L
D. 与合金反应反应的硝酸的物质的量为(![]() +
+![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化石燃料的加工说法正确的是( )
A.煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气
B.石油裂化主要得到乙烯
C.石油分馏是化学变化,可得到汽油、煤油
D.煤的气化是在高温下煤和水蒸气作用转化为可燃性气体的过程,属于物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素(H2NCONH2)是一种农业生产中常用的氮肥。在工业上,尿素还用于制造有机铁肥,如[Fe(H2NCONH2)6](NO3)3
(1)基态Fe3+的核外电子排布式为________。
(2)C、N、O三种元素的第一电离能由小到大的顺序是________。
(3)六氰合亚铁离子(Fe(CN)![]() )中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的结构式________。
)中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的结构式________。
(4)在一定条件下,NH3与CO2能合成尿素,1 mol尿素分子中,σ键的数目为________。
(5)有机铁肥[Fe(H2NCONH2)6](NO3)3化合物中,中心离子为 ____________ ,外界离子的中心原子的杂化方式:_____________ 外界离子的空间构型:___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一定量有机物和足量Na反应得到![]() L氢气,取另一份等物质的量的同种有机物和足量NaHCO3反应得
L氢气,取另一份等物质的量的同种有机物和足量NaHCO3反应得![]() L二氧化碳,若在同温同压下
L二氧化碳,若在同温同压下![]() =
=![]() ≠0,则该有机物可能是
≠0,则该有机物可能是
①CH3CH(OH)COOH ②HOOC—COOH
③CH3CH2COOH④HOOCCH2CH(OH)CH2COOH ⑤CH3CH(OH)CH2OH
A. ② B. ②③④ C. 只有④ D. ①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法错误的是( )
A.CCl4可由CH4制得,可萃取碘水中的碘
B.石油和天然气的主要成分都是碳氢化合物
C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
D.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝碱式碳酸盐MgaAlb(OH)c(CO3)d·xH2O是一种不溶于水的新型无机阻燃剂,其受热分解产物中的MgO、Al2O3熔点较高且都不燃烧,有阻燃作用。
完成下列填空:
(1).组成镁铝碱式碳酸盐的三种非金属元素的原子半径从小到大的顺序是______________。碳原子最外层电子排布式是_______________________________,铝原子核外有_________种能量不同的电子。
(2).将MgaAlb(OH)c (CO3)d·x H2O表示成氧化物的形式:2aMgO·bAl2O3·2dCO2·((______))H2O;焦炭与石英高温下在氮气流中发生如下反应,工业上可由此制得一种新型陶瓷材料氮化硅(Si3N4) :3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g) + Q (Q>0)
Si3N4(s)+6CO(g) + Q (Q>0)
(3).该反应中,氧化产物是________________________。若测得反应生成4.48 L CO气体(标准状况下),则转移的电子的物质的量为_____________。
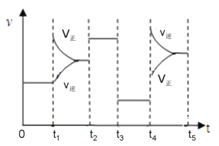
(4).该反应的平衡常数表达式K=_____________________________;若升高温度,K值____________(填“增大”、“减小”或“不变”)。该反应的速率与反应时间的关系如图所示,t4时刻引起正逆速率变化的原因是___________________________(写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关蒸馏的说法不正确的是
A.能将粗盐提纯B.能将四氯化碳和溴进行分离
C.操作时需加入几块沸石,以防暴沸D.部分蒸馏需要使用温度计便于控制温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com