
ЎҫМвДҝЎҝПВұнКЗФӘЛШЦЬЖЪұнөДТ»Іҝ·ЦЈ¬Хл¶ФұнЦРөДўЩЎ«ўбЦЦФӘЛШЈ¬МоРҙПВБРҝХ°ЧЈә
ЦЬЖЪ | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0Че |
өЪ¶юЦЬЖЪ | ўЩ | ўЪ | ||||||
өЪИэЦЬЖЪ | ўЫ | ўЬ | ўЭ | ўЮ | ўЯ | |||
өЪЛДЦЬЖЪ | ўа | ўб |
(1)ФЪХвР©ФӘЛШЦРЈ¬»ҜС§РФЦКЧоІ»»оЖГөДКЗЈә_________(МоФӘЛШ·ыәЕ)ЎЈ
(2)ФЪЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОпЦРЈ¬ЛбРФЧоЗҝөД»ҜәПОпөД·ЦЧУКҪКЗЈә_________Ј¬јоРФЧоЗҝөД»ҜәПОпөДөзЧУКҪКЗЈә_________ЎЈ
(3)ФӘЛШўЭөДөҘЦКУлФӘЛШўЫөДЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОп·ҙУҰөДАлЧУ·ҪіМКҪОӘ_________ЎЈ
(4)ФӘЛШўЪөДјтөҘЗв»ҜОпКЗУЙ_________ (МоЎ°ј«РФЎұ»тЎ°·Зј«РФЎұ)јьРОіЙөДЈ¬ФЪіЈОВПВёГ»ҜәПОпУлФӘЛШўЮөДөҘЦК·ҙУҰөДАл·ҪіМКҪОӘ__________________ЎЈ
(5)ФӘЛШўЪЎўўЫЎўўЮЎўўаЛДЦЦФӘЛШРОіЙөДАлЧУЈ¬АлЧУ°лҫ¶УЙҙуөҪРЎөДЛіРтКЗ_________ (УГАлЧУ·ыәЕұнКҫ)ЎЈ
Ўҫҙр°ёЎҝAr HClO4 ![]() 2Al+2OH-+2H2O=2AlO2-+3H2Ўь ј«РФ Cl2+H2O
2Al+2OH-+2H2O=2AlO2-+3H2Ўь ј«РФ Cl2+H2O![]() HClO+H++Cl- Cl->K+>O2->Na+
HClO+H++Cl- Cl->K+>O2->Na+
ЎҫҪвОцЎҝ
УЙФӘЛШФЪЦЬЖЪұнөДО»ЦГЈ¬ҝЙЦӘўЩЎ«ўбәЕФӘЛШ·ЦұрОӘCЎўOЎўNaЎўMgЎўAlЎўClЎўArЎўKЎўBrЈ¬И»әуЦрТ»·ЦОцҪвҙрЎЈ
ёщҫЭЙПКц·ЦОцҝЙЦӘўЩЎ«ўбәЕФӘЛШ·ЦұрОӘCЎўOЎўNaЎўMgЎўAlЎўClЎўArЎўKЎўBrЎЈ
(1)ФЪХвР©ФӘЛШЦРЈ¬»ҜС§РФЦКЧоІ»»оЖГөДКЗ¶иРФЖшМеФӘЛШArЈ»
(2)ФӘЛШөД·ЗҪрКфРФФҪЗҝЈ¬ЖдЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОпөДЛбРФҫНФҪЗҝЈ¬ФЪЙПКцФӘЛШРОіЙөДЧоёЯјЫә¬СхЛбЦРЈ¬ЛбРФЧоЗҝөДКЗHClO4Ј»ФӘЛШөДҪрКфРФФҪЗҝЈ¬ЖдЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОпөДјоРФҫНФҪЗҝЈ¬ФЪЙПКцФӘЛШЦРҪрКфРФЧоЗҝөДФӘЛШКЗKЈ¬ЛщТФјоРФЧоЗҝөДОпЦККЗKOHЈ¬ЖдөзЧУКҪОӘЈә![]() Ј»
Ј»
(3)ФӘЛШўЫКЗNaЈ¬ФӘЛШўЭКЗAlЈ¬өҘЦКAlУлNaөДЧоёЯјЫСх»ҜОп¶ФУҰөДЛ®»ҜОпNaOHИЬТә·ўЙъ·ҙУҰЈ¬ІъЙъNaAlO2әНH2Ј¬·ҙУҰөДАлЧУ·ҪіМКҪОӘЈә2Al+2OH-+2H2O=2AlO2-+3H2ЎьЎЈ
(4)ФӘЛШўЪКЗOЈ¬ЖдјтөҘЗв»ҜОпКЗH2OЈ¬УЙУЪHЎўOКЗБҪЦЦІ»Н¬өД·ЗҪрКфФӘЛШЈ¬ФӯЧУЦ®јдНЁ№эј«РФјьҪбәПЈ¬ФӘЛШўЮКЗClЈ¬Cl2УлH2OФЪіЈОВПВ·ҙУҰІъЙъHClәНHClOЈ¬ёГ·ҙУҰКЗҝЙДж·ҙУҰЈ¬УГАлЧУ·ҪіМКҪұнКҫОӘЈәCl2+H2O![]() HClO+H++Cl-ЎЈ
HClO+H++Cl-ЎЈ
(5)ФӘЛШўЪЎўўЫЎўўЮЎўўа·ЦұрКЗOЎўNaЎўClЎўKЈ¬ЛьГЗРОіЙөДАлЧУ·ЦұрКЗO2-ЎўNa+ЎўCl-ЎўK+Ј¬O2-ЎўNa+әЛНвөзЧУЕЕІјОӘ2Ўў8Ј¬Cl-ЎўK+әЛНвөзЧУЕЕІјОӘ2Ўў8Ўў8Ј¬¶ФУЪөзЧУІгҪб№№ПаН¬өДАлЧУЈ¬әЛөзәЙКэФҪҙуЈ¬АлЧУ°лҫ¶ФҪРЎЈ»АлЧУәЛНвөзЧУІгКэФҪ¶аЈ¬АлЧУ°лҫ¶ФҪҙуЈ¬ЛщТФХвЛДЦЦАлЧУ°лҫ¶УЙҙуөҪРЎөДЛіРтКЗCl->K+>O2->Na+ЎЈ


 ҝмАЦРЎІ©Кҝ№®№МУлМбёЯПөБРҙр°ё
ҝмАЦРЎІ©Кҝ№®№МУлМбёЯПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЦРС§іЈјыОпЦКAЎўBЎўCЎўDЎўEЎўXЈ¬ҙжФЪПВНјЧӘ»Ҝ№ШПө (Іҝ·ЦЙъіЙОпәН·ҙУҰМхјюВФИҘ)ЎЈПВБРНЖ¶ПІ»ХэИ·өДКЗ(ЎЎЎЎ)
![]()
A. ИфDКЗТ»ЦЦЗҝјоЈ¬ФтAЎўBЎўCҫщҝЙУлX·ҙУҰЙъіЙD
B. ИфDКЗТ»ЦЦЗҝЛбЈ¬ФтAјИҝЙТФКЗөҘЦКЈ¬ТІҝЙТФКЗ»ҜәПОпЈ¬ЗТDҝЙУлНӯ·ҙУҰЙъіЙB»тC
C. ИфDОӘNaClЈ¬ЗТAҝЙУлC·ҙУҰЙъіЙBЈ¬ФтEҝЙДЬКЗCO2
D. ИфDКЗТ»ЦЦ°ЧЙ«іБөнЈ¬ФЪҝХЖшЦРЧоЦХұдОӘәмәЦЙ«Ј¬ФтAҝЙДЬКЗМъ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВГжБРіцБЛјёЧйОпЦКЈ¬ЗлҪ«ОпЦКөДәПККЧйәЕМоРҙФЪҝХёсЙПЎЈ
ўЩ ҪрёХКҜУлКҜД«Ј» ўЪТТЛбәНҙЧЛб
ўЫ 16OәН18OЈ» ўЬCH3CH3әНCH3CH2CH3Ј»
ўЭ![]() әН
әН
(1)Н¬ЦЦОпЦК______________________________Ј»
(2)Н¬О»ЛШ_________________________Ј»
(3)Н¬ЛШТмРОМе______________________________Ј»
(4)Н¬ПөОп__________________________Ј»
(5)Н¬·ЦТм№№Ме______________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝБтәНөӘј°Жд»ҜәПОпФЪЙъІъЙъ»оЦРУҰУГ№г·әЎЈЗл»ШҙрЈә
(1)ТСЦӘ·ҙУҰЈә3NO2+H2O=2HNO3+NOЈ¬ёГ·ҙУҰЦРөДСх»ҜјБУл»№ФӯјБөДЦКБҝұИОӘ_____ЎЈ
(2)№ӨТөЙПҝЙТФНЁ№эөӘЖшәНЗвЖшФЪТ»¶ЁМхјюПВәПіЙ°ұЖшЎЈПВБР№ШУЪ°ұЖшөДРФЦКәНУГНҫГиКцХэИ·өДКЗ____________ЎЈ
A. °ұЖшТЧТә»ҜЈ¬Тә°ұҝЙЧчЦЖАдјБ B. ҝЙУГЕЕЛ®·ЁКХјҜ°ұЖш
C. °ұЖшКЗТ»ЦЦОЮЙ«ОЮО¶өДЖшМе D. Пт°ұЛ®ЦРөОјУ·УМӘЈ¬ИЬТәұдәм
(3)1754ДкЈ¬BriestlyУГі”Й°(ЦчТӘіЙ·ЭNH4Cl)әНКмКҜ»Т№ІИИЦЖөГБЛ°ұЈ¬»ҜС§·ҙУҰ·ҪіМКҪОӘ______________________________ЎЈ
(4)КөСйКТУГҪрКфНӯәНПЎПхЛбЦЖИЎNOөДАлЧУ·ҪіМКҪОӘ_____________ЎЈ
(5)ЖыіөОІЖшіЈә¬УРNOЎўNO2ЎўCOөИЈ¬»бОЫИҫҝХЖшЎЈФЪЖыіөОІЖшЕЕ·Е№ЬҙҰ°ІЧ°Т»ёцҙЯ»ҜЧӘ»ҜЖчЈ¬ҝЙК№ОІЖшЦРУРәҰЖшМеCOәНNO·ҙУҰЧӘ»ҜОӘБҪЦЦОЮ¶ҫЖшМеЈ¬ёГ·ҙУҰөД»ҜС§·ҪіМКҪОӘ__________________________ЎЈ
(6)19.2 gНӯН¶Ил100 mL 14 mol/LЕЁHNO3ИЬТәЦРЈ¬ід·Ц·ҙУҰәуОЮ№ММеКЈУаЈ¬КХјҜөҪұкЧјЧҙҝцПВЖшМе8.96 L(ЖшМеОӘNOЎўNO2)Ј¬Пт·ҙУҰәуөДИЬТәЦРјУИл______mL 10 mol/L NaOHИЬТәІЕДЬК№Cu2+НкИ«іБөнЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЗҰРоөзіШКЗөдРНөДҝЙідРНөзіШЈ¬Жр·ҙУҰОӘPb+PbO2+4H++2SO42-![]() 2PbSO4+2H2OЈәЈ¬ПВБРЛө·ЁХэИ·өДКЗ
2PbSO4+2H2OЈәЈ¬ПВБРЛө·ЁХэИ·өДКЗ
A. ·ЕөзКұёәј«ЦКБҝјхЙЩЈ¬Хэј«ЦКБҝФцјУЈ¬өзҪвЦКИЬТәЦРH2SO4өДЕЁ¶ИҪ«ұдРЎ
B. ·ЕөзКұёәј«өДөзј«·ҙУҰОӘЈәPbO2+2e-+4H++SO42-=PbSO4+2H2O
C. ідөзКұPbУлөзФҙХэј«ПаБ¬
D. ідөзКұСфј«ЙПpbSO4ұдОӘPbO2Ј¬·ўЙъСх»Ҝ·ҙУҰ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝCuSO4КЗТ»ЦЦЦШТӘ»Ҝ№ӨФӯБПЈ¬ЖдЦЖұёәНУР№ШРФЦКИзНјЛщКҫЎЈ
ЈЁ1Ј©ПЦТӘУГИзНјЛщКҫөДЕЁБтЛбАҙЕдЦЖІҪЦиўЩЦРЛщРиТӘөД1mol/LөДПЎБтЛб480mlЈ¬РиТӘУГХвЦЦЕЁБтЛбөДМе»эОӘ______mlЎЈ
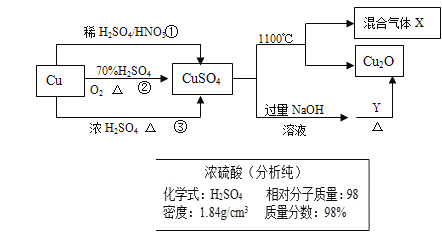
ЈЁ2Ј©ЕдЦЖёГПЎБтЛбЛщУГөҪөДІЈБ§ТЗЖчіэІЈБ§°фЎўБҝНІЎўЙХұӯНв»№УР_______Ўў__________ЎЈ
ЈЁ3Ј©ПВБРІЩЧч»бК№ЛщЕдИЬТәЕЁ¶ИЖ«өНөДКЗ _________ЎЈ
A. БтЛбЧӘТЖЦБИЭБҝЖҝәуЈ¬Г»УРПҙөУЙХұӯ
B. ОҙАдИҙЦБКТОВҫНЧӘТЖЦБИЭБҝЖҝ
C. ИЭБҝЖҝЦРҙжФЪЙЩБҝХфБуЛ®
D. ¶ЁИЭКұё©КУҝМ¶И E.БҝИЎЕЁБтЛбКұБҝНІДЪУРЙЩБҝХфБуЛ®
ЈЁ4Ј©ЦЖИЎБтЛбНӯөДНҫҫ¶ўЩўЪўЫЦРЈ¬Нҫҫ¶_________ДЬёьәГөШМеПЦВМЙ«»ҜС§өДЛјПлЎЈ
ЈЁ5Ј©ЕдЦЖ1000ml 0.1mol/LөДБтЛбНӯИЬТәЈ¬РиУГНРЕММмЖҪіЖИЎ________gөЁ·ҜЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ӨТөЙПЦЖұёПВБРОпЦКөДЙъІъБчіМәПАнөДКЗ(ЎЎЎЎ)
A. УЙВБНБҝуТұБ¶ВБЈәВБНБҝу![]() Al2O3
Al2O3![]() AlCl3
AlCl3![]() Al
Al
B. ҙУәЈЛ®ЦРМбИЎГҫЈәәЈЛ®![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
C. УЙNaClЦЖЖҜ°Ч·ЫЈәұҘәНКіСОЛ®![]() Cl2
Cl2![]() ЖҜ°Ч·Ы
ЖҜ°Ч·Ы
D. УЙ»ЖМъҝуЦЖБтЛбЈә»ЖМъҝу![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРЛө·ЁХэИ·өДКЗ
A. НӯөДҪрКф»оЖГРФұИМъөДИхЈ¬ҝЙФЪәЈВЦНвҝЗЙППвИлИфёЙНӯҝйТФјх»әЖдёҜКҙ
B. Пт0.1 molЎӨLЈӯ1 CH3COONaИЬТәЦРјУИлЙЩБҝЛ®Ј¬ИЬТәЦРc(H+)/c(CH3COO-)јхРЎ
C. ·ҙУҰTiO2(s)Ј«2Cl2(g)===TiCl4(g)Ј«O2(g)Ј»ҰӨH>0ДЬЧФ·ўҪшРРЈ¬ЖдФӯТтКЗҰӨS>0
D. Т»¶ЁОВ¶ИПВЈ¬Фцҙу·ҙУҰ2BaO2(s)![]() 2BaO(s) Ј«O2(g)ИЭЖчөДМе»эЈ¬ЖҪәвІ»ТЖ¶Ҝ
2BaO(s) Ј«O2(g)ИЭЖчөДМе»эЈ¬ЖҪәвІ»ТЖ¶Ҝ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ¶ФУЪ·ҙУҰA(g)+4B(g)![]() 2C(g)+2D(g)Ј¬ПВБРКэҫЭұнКҫ·ҙУҰҪшРРөГЧоҝмөДКЗЈЁ Ј©
2C(g)+2D(g)Ј¬ПВБРКэҫЭұнКҫ·ҙУҰҪшРРөГЧоҝмөДКЗЈЁ Ј©
A.v(A)=1.4mol/(Ls)B.v(B)=3.6 mol/(Ls)
C.v(C)=2mol/(Ls)D.v(D)=30 mol/(Lmin)
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com