
工业废水中常含有一定量的Cr2O72﹣和CrO42﹣,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.
方法1:还原沉淀法该法的工艺流程为:CrO42﹣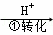 Cr2O72﹣
Cr2O72﹣ Cr3+
Cr3+ Cr(OH)3↓其中第①步存在平衡:2CrO42﹣(黄色)+2H+⇌Cr2O72﹣(橙色)+H2O
Cr(OH)3↓其中第①步存在平衡:2CrO42﹣(黄色)+2H+⇌Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显 橙 色.
(2)能说明第①步反应达平衡状态的是 c .
a.Cr2O72﹣和CrO42﹣的浓度相同 b.2v(Cr2O72﹣)=v(CrO42﹣) c.溶液的颜色不变
(3)第②步中,还原1molCr2O72﹣离子,需要 6 mol的FeSO4•7H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH﹣(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH﹣)=10﹣32,要使c(Cr3+)降至10﹣5mol/L,溶液的pH应调至 5 .
方法2:电解法,该法用Fe做电极电解含Cr2O72﹣的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe做电极的原因为 阳极反应为Fe﹣2e﹣═Fe2+,提供还原剂Fe2+ .
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 2H++2e﹣═H2↑ ,溶液中同时生成的沉淀还有 Fe(OH)3 .
| 化学平衡移动原理;氧化还原反应的电子转移数目计算;原电池和电解池的工作原理;化学平衡状态的判断;难溶电解质的溶解平衡及沉淀转化的本质. . | |
| 专题: | 压轴题. |
| 分析: | (1)根据外界条件对平衡的影响来考虑平衡移动方向,从而确定离子浓度大小,进而确定颜色变化; (2)判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变,即能变的量保持不变则说明已达平衡; (3)根据得失电子守恒来计算; (4)根据溶度积常数进行计算; (5)阳极是活性电极时,阳极本身失电子,生成阳离子; (6)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀. |
| 解答: | 解:(1)c(H+)增大,平衡2CrO42﹣(黄色)+2H+⇌Cr2O72﹣(橙色)+H2O右移,溶液呈橙色; (2)平衡时各物质的浓度不再改变,即溶液的颜色不再改变; (3)根据电子得失守恒可知,还原1molCr2O72﹣离子得到Cr3+,得电子:2×(6﹣3)=6mol,需要FeSO4•7H2O的物质的量为:6÷(3﹣2)=6; (4)当c(Cr3+)=10﹣5mol/L时,溶液的c(OH﹣)= (5)在电解法除铬中,铁作阳极,阳极反应为Fe﹣2e﹣═Fe2+,以提供还原剂Fe2+; (6)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2的同时,大量产生了OH﹣,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀. 故答案为:(1)橙;(2)c;(3)6;(4)5;(5)阳极反应为Fe﹣2e﹣═Fe2+,提供还原剂Fe2+;(6)2H++2e﹣═H2↑;Fe(OH)3. |
| 点评: | 本题综合考查了化学平衡原理、氧化还原反应、沉淀溶解平衡和电化学知识等内容.分析时要根据题给信息,结合相关原理进行解答. |


科目:高中化学 来源: 题型:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
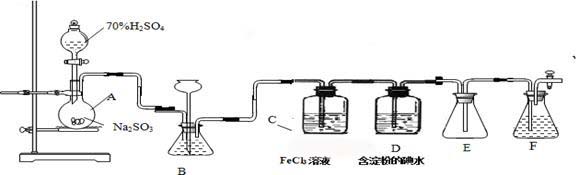
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置E的作用是 。装置F中为 溶液。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)SO2气体还原Fe3+反应的产物是________________(填离子符号)。
(4)在上述装置中通入过量的SO2为了验证C中SO2与Fe3+发生了氧化还原反应,他们取C中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是____ ,原因是_______________________________________。
(5)能表明I-的还原性弱于SO2的现象是__________________________,
写出有关离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应M+N→P,如果温度每升高10℃,化学反应速度增大为原来的3倍,在10℃时,完成反应10%需81min,则在30℃时完成反应10%需要时间为( )
A.27min B.9min C.13.5min D.3min
查看答案和解析>>
科目:高中化学 来源: 题型:
控制适当的条件,将反应Fe3++Ag═Fe2++Ag+设计成如图所示的原电池.下列判断正确的是( )
|
| A. | 反应开始时,石墨棒作阳极,银棒作阴极 |
|
| B. | 灵敏电流计的读数由小变大,再变小 |
|
| C. | 反应达化学平衡时,电流计读数最大 |
|
| D. | 反应达化学平衡时,在乙烧杯中滴入一定量的NaCl溶液,电流计指针又偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1L0.1mol•L﹣1 AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时,下列判断正确的是(设电解按理论进行,溶液不蒸发)( )
|
| A. | 转移的电子数是1.204×1022 | B. | 阳极上产生112mLO2(标准状况) |
|
| C. | 溶液的浓度变化为0.08mol•L﹣1 | D. | 反应中有0.01molAg被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.除去Cu2+中的少量Fe3+,可加入CuO
B.沸点:晶体硅 > SiO2 > SiCl4 > NaCl
C.Cu(NH3)42+中的配位键是由Cu2+提供孤对电子,NH3提供空轨道形成的
D.石油的分馏、煤的液化以及煤的干馏等生产过程中均只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸是一种常见的弱酸,回答下列问题:
(1)醋酸的电离方程式是 ;下列哪些措施能够使醋酸溶液中c(H+) / c(CH3COO-) 增大的是
a. 升温 b. 通入HCl气体 c. 加入NaOH固体 d. 加入NaHSO4固体
(2)向100ml 0.1mol·L-1的醋酸中加入V ml 0.1mol·L-1的NaOH溶液完全反应后,溶液呈中性,则V 100ml (填“>”,“<”或“=”)
(3)在CH3COOH与CH3COONa的混合溶液中,测得某一时刻混合溶液中c(CH3COO-) / c(CH3COOH) = 18,则此时溶液的pH = (已知:CH3COOH的电离常数Ka=1.8×10-5)
(4)为测定食用醋中醋酸的含量(用每升食醋中所含醋酸的质量表示,单位:g/L),设计如下实验:a. 取20ml食醋于锥形瓶中,滴加2—3滴酚酞作指示剂。b. 向碱式滴定管中加入1mol·L-1的NaOH溶液,调整液面,并记下初始刻度。c. 开始滴定,并记录滴定终点时碱式滴定管的刻度,重复试验2—3次。
① 达到滴定终点时的现象是
② 经过测定,消耗NaOH溶液的体积为10ml,则该食醋中醋酸的含量是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是( )
|
| A. | 小苏打溶液与稀硫酸混合:CO32﹣+2H+═CO2↑+H2O |
|
| B. | 石灰水与足量的碳酸氢钾溶液反应:HCO3﹣+Ca2++OH﹣═CaCO3↓+H2O |
|
| C. | 大理石跟醋酸溶液反应:CaCO3+2CH3COOH═Ca2++2CH3COO﹣+H2O+CO2↑ |
|
| D. | 过氧化钠与水的反应:2O22﹣+2H2O═4OH﹣+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效、安全灭菌消毒剂,ClO2是一种消毒杀菌效率高、二次污染小的水处理剂,它在食品保鲜、饮用水消毒等方面有着广泛的应用。
(1)实验室制备ClO2的方法之一为:
2KClO3+H2C2O4+H2SO4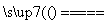 2ClO2↑+K2SO4+2CO2↑+2H2O(H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是________。
2ClO2↑+K2SO4+2CO2↑+2H2O(H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是________。
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被氧化
D.1 mol KClO3参加反应有2 mol电子转移
(2)KClO3和浓盐酸在一定温度下反应也会生成绿黄色的二氧化氯。其变化可表示为2KClO3+4HCl(浓)===2KCl+2ClO2↑+Cl2↑+2H2O
①浓盐酸在反应中表现出来的性质是__________________________________________;
②已知每产生0.1 mol Cl2,则发生转移的电子的物质的量为0.2 mol。ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒后的还原产物是氯离子,则其消毒的效率(以单位质量得到的电子数表示)是Cl2的________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com