
����Ŀ���⻯����ҽҩ��������״���������μ�����̵�����������Ҳ����ʳƷ���Ӽ����й���ȡ� ��ҵ����NaOH��Һ��ˮ������ȡ�⻯�ƹ��壬���Ʊ�����ͼ���£�

��֪��N2H4��H2O��100�����Ϸֽ⡣
��1����֪���ںϳɹ��̵ķ�Ӧ�����к���NaIO3�����ںϳɹ�����������3 mol I2 �������� NaIO3�����ʵ���Ϊ mol��
��2��д����ԭ�����е����ӷ���ʽ ���ڻ�ԭ�����У�Ϊ�˼ӿ췴Ӧ���ɲ�ȡ����߷�Ӧ�¶ȣ����¶Ȳ��ó��� ������ѡ�������Լ�������õ⻯�ƹ������Ƿ���NaIO3���� (ѡ����ĸ)��
A.FeCl2��Һ B.������ C.KI��Һ D.������Һ
��3���ⶨ��Ʒ��NaI������ʵ�鲽�����£�
a.��ȡ4.000 g ��Ʒ���ܽ⣬��250 mL ����ƿ�ж��ݣ�
b.��ȡ25.00 mL ����Һ����ƿ�У�Ȼ�����������FeCl3��Һ����ַ�Ӧ���ټ���A��Һ��ָʾ����
c.�� 0.1000 mol��L 1 ��Na2S2O3��Һ���еζ����յ�(������Ӧ�ķ���ʽΪ��
2Na2S2O3 +I2![]() Na2S4O6 +2NaI)���ظ��ⶨ2�Σ����õ�����������±���
Na2S4O6 +2NaI)���ظ��ⶨ2�Σ����õ�����������±���
�ⶨ��� | ����Һ���/ mL | ��Һ�ζ���������/ mL | ��Һ�ζ����յ����/ mL |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
������b�У�����������FeCl3��Һʱ�����������ӷ���ʽΪ ��
������A����Ϊ (������)���ζ��յ�۲쵽������Ϊ ��
���������Ʒ��NaI�ĺ���Ϊ ��(ֻд���о�����ֵ�ı���ʽ����)
��4���⻯�ƹ���ı��淽���� ��
���𰸡���1�� 1
��2��2![]() +3N2H4��H2O
+3N2H4��H2O![]() 3N2 +2I +9H2O 100 BD
3N2 +2I +9H2O 100 BD
��3����2Fe3+ +2I![]() 2Fe2++I2
2Fe2++I2
��������Һ ��Һ��dz��ɫ��ɫ���Ұ�����ڲ���ɫ ��![]() 100%
100%
��4������ɫƿ�ڹ⡢�ܷⱣ��
�����������⿼�黯ѧ�������̣��漰������ԭ��Ӧ����ʽ����д�����㡢���ӵļ��顢�ζ��������ʵĺ����ȡ���1�����ݷ�Ӧ3I2+6NaOH![]() 5NaI+NaIO3+3H2O��������3 mol I2ʱ��������NaIO3�����ʵ���Ϊ1 mol��
5NaI+NaIO3+3H2O��������3 mol I2ʱ��������NaIO3�����ʵ���Ϊ1 mol��
��2����ԭ������NaIO3��N2H4��H2O����ΪN2����������ԭΪNaI�����ӷ���ʽΪ2![]() +3N2H4��H2O
+3N2H4��H2O![]() 3N2 +2I+9H2O��������֪��N2H4��H2O��100�����Ϸֽ⣬���ڻ�ԭ�����У��¶Ȳ��ó���100����NaI��NaIO3�������������ܷ����绯��Ӧ���ɵⵥ�ʣ����õ�����Һ�������ɵĵⵥ�ʣ���ѡBD��
3N2 +2I+9H2O��������֪��N2H4��H2O��100�����Ϸֽ⣬���ڻ�ԭ�����У��¶Ȳ��ó���100����NaI��NaIO3�������������ܷ����绯��Ӧ���ɵⵥ�ʣ����õ�����Һ�������ɵĵⵥ�ʣ���ѡBD��
��3�����ⶨ��Ʒ��NaI������ʵ��ԭ���ǣ���Fe3+���ӽ�I��������ΪI2������Na2S2O3���еζ��������b�У�����������FeCl3��Һʱ�����������ӷ���ʽΪ��2Fe3+ +2I![]() 2Fe2++I2������������۱�Ϊ��ɫ���ζ���ʱ�õ�����ָʾ��������������AΪ���ۣ��ζ��յ�۲쵽������Ϊ����Һ��dz��ɫ��ɫ���Ұ�����ڲ���ɫ�������ݼ����֪����ʵ������Na2S2O3��Һ��ƽ�����Ϊ24.00 mL����n(Na2S2O3)=0.1000 mol��L 1��0.024 L=2.4��103 mol����2NaI ~I2~2Na2S2O3֪��n(NaI)= 2.4��103 mol�������Ʒ��NaI�ĺ���Ϊ
2Fe2++I2������������۱�Ϊ��ɫ���ζ���ʱ�õ�����ָʾ��������������AΪ���ۣ��ζ��յ�۲쵽������Ϊ����Һ��dz��ɫ��ɫ���Ұ�����ڲ���ɫ�������ݼ����֪����ʵ������Na2S2O3��Һ��ƽ�����Ϊ24.00 mL����n(Na2S2O3)=0.1000 mol��L 1��0.024 L=2.4��103 mol����2NaI ~I2~2Na2S2O3֪��n(NaI)= 2.4��103 mol�������Ʒ��NaI�ĺ���Ϊ![]() 100%��
100%��
��4���⻯�Ƽ����ֽ⣬���ױ��������������Ե⻯�ƹ���Ӧ����ɫƿ�ڹ⡢�ܷⱣ�档



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ�鷽����������NaCl��BaCl2���ֹ��������ѡ�Լ���Na2SO4��Һ��Na2CO3��Һ��K2CO3��Һ������

��1�������ڵ�������_______________________
��2���Լ�a��__________________���Լ�b��____________________
��3�� �����Լ�b��������Ӧ�����ӷ���ʽΪ____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��ͭ�ͼ�ʽ̼��ͭ������������ת��Ϊ�Ȼ�ͭ�������������ֻ�������ֽܷ������ͭ���ܽ�28.4g������������1mol/L����500mL�����յ����������������õ�����ͭ��������
A. 35g B. 30g C. 20g D. 15g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�Ԫ�����ʵĵݱ���ɴ�����ǣ�����
A.Li��Be��Bԭ��������������������
B.P��S��ClԪ�ص���������ϼ���������
C.B��C��N��O��Fԭ�Ӱ뾶��������
D.Li��Na��K��Rb�Ľ�����������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ҫ������������ԭ��������ˮ��Һ�ֳ�Ϊ˫��ˮ��������������ɱ����Ư�ȡ�ij��ѧ��ȤС��ȡһ�����Ĺ���������Һ��ȷ�ⶨ�˹�������ĺ���������д���пհף�
��ȡ10.00 mL�ܶ�Ϊ�� g/mL�Ĺ�������ԭ��Һϡ�ͳ�250 mL����ȡϡ����������Һ25.00 mL����ƿ�У�����ϡ�����ữ��������ˮϡ�ͣ�������������
��1���ø�����ط�(һ��������ԭ�ζ���)�ɲⶨ����Һ�е�H2O2�ĺ�������������Ũ��Ϊ0.10 mol��L1��KMnO4����Һ500 mL��Ӧȷ��ȡ_________g KMnO4[��֪M(KMnO4)=158.0 g��mol1]��
a.���Ƹñ���Һʱ�����������в���Ҫ�õ�����_________��(�ñ�ű�ʾ)��
��������ƽ ���ձ� ����Ͳ �������� ������ƿ ����ͷ�ι� ����Һ��
b.����ʱ���Ӷ������������ս��__________(�ƫ��ƫС�����䡱)��
��2����ɲ���ƽ���ӷ���ʽ��
![]()
![]() ��
��![]() H2O2��
H2O2��![]()
![]()
![]() Mn2+��
Mn2+��![]() O2����
O2����![]()
��3���ζ�ʱ����������ر���Һע��____________(���ʽ����ʽ��)�ζ����С��ζ������յ��������____________________________________________��
��4���ظ��ζ����Σ�ƽ������KMnO4����ҺV mL����ԭ����������Һ�й����������������Ϊ_____________��
��5�����ζ�ǰ�ζ��ܼ����������ݣ��ζ���������ʧ����ⶨ���______________ (�ƫ�ߡ���ƫ�͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵı仯������,���ۼ����Ա��ƻ�����
A. ��NH4HCO3���ŵ��˴̼�����ζ B. NaCl����������
C. I2���� D. NaOH����ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]��15�֣�
�о����֣���CO2��ѹ�ϳɼ״���Ӧ��CO2+3H2=CH3OH+H2O���У�Co�����︺�ص�Mn�������������Ӵ������и��ԣ���ʾ�����õ�Ӧ��ǰ�����ش��������⣺
��1��Co��̬ԭ�Ӻ�������Ų�ʽΪ_____________��Ԫ��Mn��O�У���һ�����ܽϴ����_________����̬ԭ�Ӻ���δ�ɶԵ������϶����_________________��
��2��CO2��CH3OH������Cԭ�ӵ��ӻ���ʽ�ֱ�Ϊ__________��__________��
��3����CO2��ѹ�ϳɼ״���Ӧ���漰��4�������У��е�Ӹߵ��͵�˳��Ϊ_________��ԭ����______________________________��
��4�����������Ʊ�������Ӧ������ԭ�ϣ�Mn(NO3)2�еĻ�ѧ�������Ҽ�����������________��
��5��MgO����NaCl�ͽṹ����ͼ�������������Ӳ��������������ܶѻ���ʽ��X��������ʵ����MgO�ľ�������Ϊa=0.420nm����r(O2-)Ϊ________nm��MnOҲ����NaCl�ͽṹ����������Ϊa' =0.448 nm����r(Mn2+)Ϊ________nm��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������塷�жԾ�����˪������������������ȡ��֮�������������û��ϣ�������֮���������Ϸ��Ÿ�������������Ȼ�´����飬�ⳤ��Ϊʤ��ƽ���ߴ�֮���������漰�IJ���������(����)
A.����B.��ȡC.����D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ǰ㳣�õĽ���֮һ�������Ͻ��仯����������Ҫ����;��
��l��ij����̼������X�����ֵ�ԭ�ϣ���������֪��X������̼��Ԫ�ص�������Ϊ14��1����X�Ļ�ѧʽ________��X�������Ŀ����и������գ������д��ԵĹ���Y����ʹ����ʯ��ˮ����ǵ����壬�÷�Ӧ�Ļ�ѧ����ʽΪ___________________��
��2�����ѺϽ���һ�ֳ��ò���ֲ��ϣ�ijͬѧ��̽���úϽ�����ʱ��������TiO2+��Fe3+��Һ�м�����м����Һ����ɫ���ù����з����ķ�Ӧ�У�
��2Fe3++Fe��3Fe2+ ��Ti3+����ɫ����Fe3++H2O=TiO2+����ɫ��+Fe2+��2H+
��_______________________��
��3������������Ҫ�Ĺ�ҵԭ�ϣ��÷���м�Ʊ������������£�
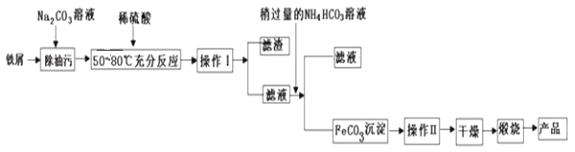
�ش��������⣺
�ٲ������������_________��
�����������FeCO3���������ӷ���ʽ��_____________��FeCO3�ﵽ�����ܽ�ƽ��ʱ�������²����Һ��pHΪ8��c(Fe2+)Ϊ1.0��10-5mol/L�����ж�����FeCO3�����Ƿ����Fe(OH)2:____����ǡ�������ͨ������˵������___________��
����֪Ksp[Fe(OH)2]=4.9��10-17mol3��L-3 ��Ksp[FeCO3]=2.1��10-11mol2��L-2��
�������������֣���Ʒ�н���Fe2+���ڣ������ʵ������Ʒ������Fe2+��
_______________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com