
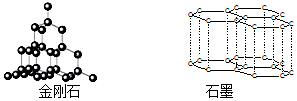
| A. | 根据:C(金刚石,s)+O2(g)═CO2(g)△H=-395.41 kJ•mol-1C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1说明金刚石比石墨稳定,石墨转变为金刚石为放热反应 | |
| B. | 相同质量的金刚石与石墨晶体中,所含共价键数相同 | |
| C. | 估计金刚石与石墨的熔沸点均较高,硬度均较大 | |
| D. | 现代科技已经实现了石墨制取金刚石,该过程属于化学变化 |
分析 A、由石墨、金刚石燃烧的热化学方程式①C(石墨)+O2(g)=CO2(g)△H=-393.51kJ•mol-1
②C(金刚石)+O2(g)=CO2(g)△H=-395.41kJ•mol-1,
利用盖斯定律将①-②可得:C(石墨)=C(金刚石)△H=+1.9kJ•mol-1,由此分析解答;
B、金刚石中1molC均形成2mol共价键,石墨中1molC均形成1.5mol共价键;
C、石墨的硬度小,金刚石的硬度大;
D、有新物质生成的反应是化学变化.
解答 解:A、由石墨、金刚石燃烧的热化学方程式①C(石墨)+O2(g)=CO2(g)△H=-393.51kJ•mol-1
②C(金刚石)+O2(g)=CO2(g)△H=-395.41kJ•mol-1,
利用盖斯定律将①-②可得:C(石墨)=C(金刚石)△H=+1.9kJ•mol-1,则由石墨制备金刚石是吸热反应,石墨的能量低于金刚石,所以石墨比金刚石更高稳定,故A错误;
B.金刚石中每个C原子与相邻的4个C成键,因此1molC形成2mol共价键,石墨中每个C原子与相邻的3个C成键,1molC均形成1.5mol共价键,等质量时二者含有的共价键之比为4:3,故B错误;
C、石墨的硬度小,金刚石的硬度大,所以不是硬度均较大,故C错误;
D、石墨和金刚石是不同物质,两者之间的转化是化学变化,故D正确;
故选D.
点评 本题考查较为综合,涉及盖斯定律、晶体以及晶胞的计算等问题,题目难度中等,注意金刚石与石墨晶体的结构.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
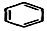 +H2C═CH2$\stackrel{一定条件}{→}$
+H2C═CH2$\stackrel{一定条件}{→}$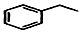
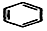 +2H2C═CH2$\stackrel{一定条件}{→}$
+2H2C═CH2$\stackrel{一定条件}{→}$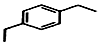
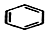 +2H2C═CH2$\stackrel{一定条件}{→}$
+2H2C═CH2$\stackrel{一定条件}{→}$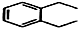
 .
.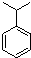 . N:
. N: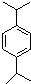 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入BaCl2溶液,产生了白色沉淀,再加入足量的HCl溶液,沉淀不溶解,溶液中一定含有大量SO${\;}_{4}^{2-}$ | |
| B. | 加入足量的CaCl2溶液,产生了白色沉淀,加入盐酸可以产生无色且能使澄清石灰水变浑浊的气体,则该溶液不一定含有大量的CO${\;}_{3}^{2-}$ | |
| C. | 加入足量浓 NaOH溶液加热,产生了带有强烈刺激性气味的能使湿润的红色石蕊试纸变蓝的气体,溶液中一定含有大量的NH${\;}_{4}^{+}$ | |
| D. | 先加适量的硝酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.溶液中一定含有大量的Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1 | B. | 1.5 mol•L-1 | C. | 2 mol•L-1 | D. | 2.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
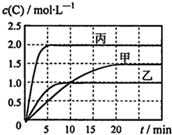 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T3 |
| 反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 达平衡时A(g)的浓度:乙=丙>甲 | |
| B. | 甲容器中达平衡时B(g)的转化率为75% | |
| C. | 温度分别为T1、T2时,该反应的平衡常数:K(T1)<K(T2) | |
| D. | 丙容器中达到平衡后,若同时向容器中再充入1mol A(g)、1mol B(g)、1molC(g),则平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com