
【题目】H2S水溶液中存在电离平衡H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-。若向H2S溶液中 ( )
H++S2-。若向H2S溶液中 ( )
A. 加水,平衡向右移动,溶液中氢离子浓度增大
B. 通入过量SO2气体,平衡向左移动,溶液pH值增大
C. 滴加新制氯水,溶液pH值减小
D. 加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
【答案】C
【解析】A.加水稀释促进硫化氢电离,但氢离子浓度减小,故A错误;B.二氧化硫和硫化氢反应方程式为SO2+2H2S=3S↓+2H2O,溶液的酸性减弱,pH值增大,二氧化硫过量后,二氧化硫和水反应方程式为H2O+SO2=H2SO3,亚硫酸酸性大于氢硫酸,所以溶液的pH又减小,故B错误;C.氯气和硫化氢反应方程式为Cl2+H2S=S↓+2HCl,通入氯气后,H2S水溶液变成氯化氢的水溶液,盐酸的酸性大于氢硫酸,所以溶液的pH减小,故C正确;D.加入硫酸铜溶液发生反应CuSO4+H2S=H2SO4+CuS↓,生成硫酸,硫酸的酸性大于氢硫酸,所以氢离子和硫酸根离子浓度增大,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】按要求填空
催化剂能改变化学反应的速率,原因是改变化学反应的路径.某同学在实验中发现,向2mL5%H2O2溶液中分别滴入FeCl3和FeCl2溶液,都立即产生大量气泡;向反应后的溶液中滴入几滴KSCN溶液,溶液均变为红色.查阅资料知:FeCl3在H2O2分解中发生如下反应:
①2Fe3++H2O2═2Fe2++2H++O2↑ ②2Fe2++2H++H2O2═2Fe3++2H2O
(1)在反应①中Fe3+作;在反应②中Fe3+是 . 有同学认为Fe2+也可作H2O2分解的催化剂,你认为该观点是否正确,并简述理由
.
(2)反应2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,加入少许MnSO4固体能明显观察到溶液紫色褪去时间变短.在试管中加入4mL0.01mol/LKMnO4酸性溶液和2mL0.1mol/LH2C2O4溶液,实验初始阶段时间﹣速率图象合理的是图1中的(填序号). 
(3)某反应体系中存在A、B、C、D四种物质,反应过程中各物质的物质的量变化如图2所示,请写出该反应的化学方程式 .
(4)焙烧明矾产生的SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)═2SO3(g)△H1=﹣197kJmol﹣1;
H2O(g)═H2O(l)△H2=﹣44kJmol﹣1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=﹣545kJmol﹣1 .
则SO3(g)与H2O(l)反应的热化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列有关叙述正确的是
为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,22.4LH202中含有共价键的数目为3![]()
B. 4.6g甲苯(C7H8)和丙三醇(C3H803)的混合物中含有的氢原子数为0.4![]()
C. 50mL18.4molL-1浓硫酸与足量铜微热反应,转移的电子数目为0.92![]()
D. 已知 S02(g)+l/202(g)=S03(g) △H=-98.32 KJ.mol-1,则向容器中充入![]() 个 S02分子和0.5
个 S02分子和0.5![]() 个02分子在一定条件下充分反应,最终放出的热量为98.32 kJ
个02分子在一定条件下充分反应,最终放出的热量为98.32 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果不正确的是( ) 
A.图中,AB段的反应为Fe+2Fe3+=3Fe2+ , 溶液中溶质最终为FeSO4
B.原溶液中H2SO4浓度为2.5molL﹣1
C.原混合溶液中NO3﹣的物质的量为0.4mol
D.图中,OA段产生的气体是NO,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g)![]() 2Z(g),有关下列图像的说法不正确的是( )
2Z(g),有关下列图像的说法不正确的是( )

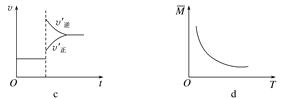
A. 依据图a可判断正反应为放热反应
B. 在图b中,虚线可表示使用了催化剂
C. 若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动
D. 由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质互为同分异构体的是
A. O2和O3 B. CH3CH2CH2CH3和CH(CH3)3
C. 12C和13C D. CH4和CH3CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)下列有关NH3的说法中,不正确的是__________(双选)。
A.工业合成NH3需要在高温高压下进行 B. NH3可用来生产碳铵和尿素等化肥
C. NH3可用浓硫酸或无水氯化钙干燥 D. NH3受热易分解,须置于冷暗处保存
(2)NH3易于水,标准状况下,用充满NH3的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为__________mol.L-1。
(3)氨气燃烧的化学方程式为_______________。
(4)HNO3是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的______________性。
(5)“吸收塔” 尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为:
Na2CO3+2NO2=NaNO3+________+CO2 (请填写完成化学方程式)。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为__________,若用通式NOx表示氧化物,则每摩尔氨可将________mol的NOx转化为N2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com